[ad_1]
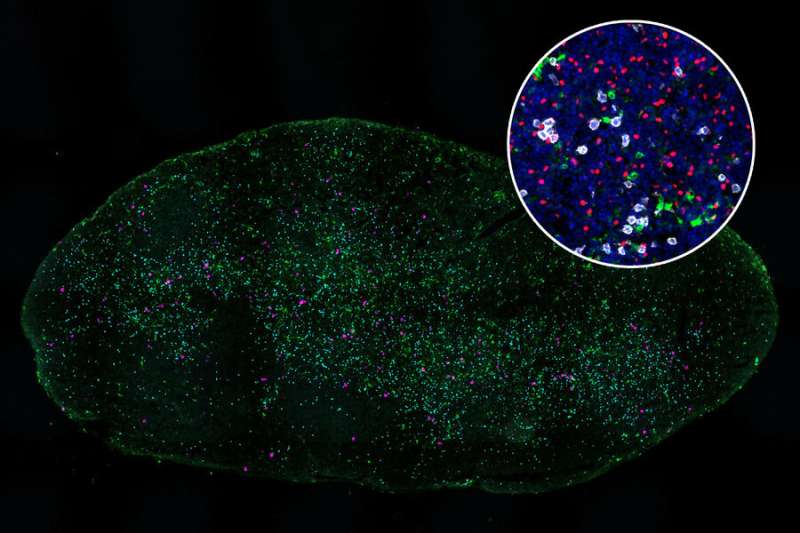
یک مطالعه جدید MIT توضیح میدهد که چرا سلولهای دندریتیک (سبز) در غدد لنفاوی که از ریهها تخلیه میشوند، قادر به تحریک سلولهای T کشنده (سفید) برای حمله به تومورهای ریه نیستند. اعتبار: MIT
ایمونوتراپی – درمان دارویی که سیستم ایمنی را برای حمله به تومورها تحریک می کند – در برابر برخی از انواع سرطان به خوبی عمل می کند، اما موفقیت آمیزی در برابر سرطان ریه نشان داده است.
یک مطالعه جدید از MIT کمک می کند تا روشن شود که چرا سیستم ایمنی بدن چنین پاسخ ضعیفی به سرطان ریه نشان می دهد، حتی پس از درمان با داروهای ایمونوتراپی. در مطالعهای روی موشها، محققان دریافتند که باکتریهایی که به طور طبیعی در ریهها یافت میشوند به ایجاد محیطی کمک میکنند که فعالسازی سلولهای T را در غدد لنفاوی نزدیک ریهها سرکوب میکند.
محققان آن نوع محیط سرکوب کننده سیستم ایمنی را در غدد لنفاوی نزدیک تومورهایی که در نزدیکی پوست موش رشد می کنند، پیدا نکردند. آنها امیدوارند که یافته های آنها بتواند به توسعه راه های جدیدی برای افزایش پاسخ ایمنی به تومورهای ریه کمک کند.
ماریا زاگورولیا، دانشجوی فارغ التحصیل MIT، نویسنده اصلی مقاله است که امروز در مجله منتشر شده است مصونیت.
“یک تفاوت عملکردی بین پاسخهای سلول T که در غدد لنفاوی مختلف نصب میشوند وجود دارد. ما امیدواریم راهی برای مقابله با این پاسخ سرکوبکننده شناسایی کنیم تا بتوانیم سلولهای T هدفدار تومور ریه را دوباره فعال کنیم.” استفانی اسپرانگر، هاوارد اس و لیندا بی استرن، استادیار توسعه شغلی زیست شناسی، عضو موسسه کخ MIT برای تحقیقات سرطان یکپارچه، و نویسنده ارشد مطالعه جدید می گوید.
اعتبار: مصونیت (2023). DOI: 10.1016/j.immuni.2023.01.010 یک مطالعه جدید MIT توضیح می دهد که چرا سلول های دندریتیک (سبز) در غدد لنفاوی که از ریه ها تخلیه می شوند، نمی توانند سلول های T کشنده (سفید) را برای حمله به تومورهای ریه تحریک کنند. اعتبار: موسسه فناوری ماساچوست
حمله نکردن
برای سالها، دانشمندان میدانستند که سلولهای سرطانی میتوانند سیگنالهای سرکوبکننده سیستم ایمنی را ارسال کنند، که منجر به پدیدهای به نام فرسودگی سلولهای T میشود. هدف از ایمونوتراپی سرطان، جوان سازی آن سلول های T است تا بتوانند دوباره به تومورها حمله کنند.
یکی از داروهایی که معمولاً برای ایمونوتراپی استفاده میشود، شامل مهارکنندههای ایست بازرسی است که ترمزهای سلولهای T خسته را از بین میبرند و به فعال شدن مجدد آنها کمک میکنند. این رویکرد در مورد سرطان هایی مانند ملانوما به خوبی جواب داده است، اما در مورد سرطان ریه نه.
کار اخیر اسپرانگر یک توضیح احتمالی برای این موضوع ارائه کرده است: او دریافت که برخی از سلولهای T حتی قبل از رسیدن به تومور، به دلیل فعال نشدن در اوایل رشدشان، از کار میافتند. در مقالهای در سال 2021، او جمعیتهایی از سلولهای T ناکارآمد را شناسایی کرد که میتوان آنها را از سلولهای T معمولی با الگوی بیان ژنی که از حمله به سلولهای سرطانی هنگام ورود به تومور جلوگیری میکند، از آنها متمایز کرد.
اسپرانگر میگوید: «با وجود این واقعیت که این سلولهای T در حال تکثیر هستند و در حال نفوذ به تومور هستند، هرگز مجوز کشتن نداشتند.
در مطالعه جدید، تیم او بیشتر به بررسی این شکست فعالسازی پرداخت که در غدد لنفاوی رخ میدهد، غدد لنفاوی که مایعات تخلیه شده از بافتهای مجاور را فیلتر میکنند. غدد لنفاوی جایی هستند که «سلولهای T قاتل» با سلولهای دندریتیک مواجه میشوند که آنتیژنها (پروتئینهای تومور) را ارائه میکنند و به فعال کردن سلولهای T کمک میکنند.
برای بررسی اینکه چرا برخی از سلولهای T کشنده به درستی فعال نمیشوند، تیم اسپرانگر موشهایی را که تومورهای کاشته شده در ریه یا پهلو داشتند، مورد مطالعه قرار دادند. همه تومورها از نظر ژنتیکی یکسان بودند.
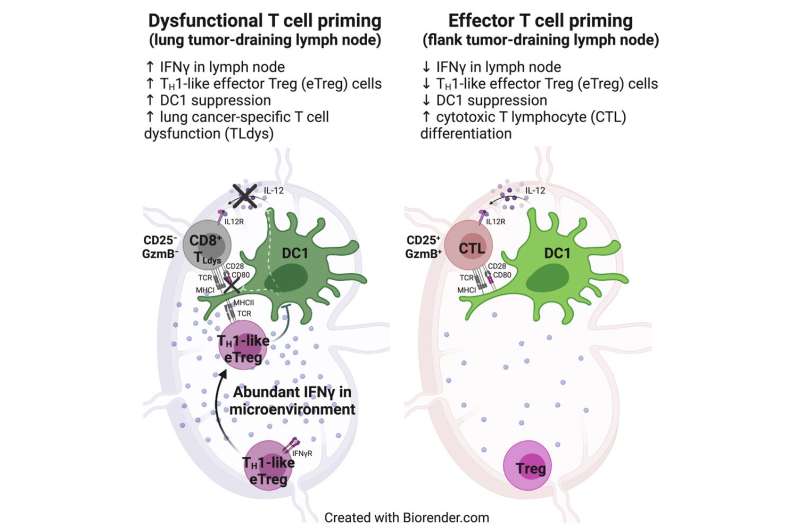
محققان دریافتند که سلولهای T در غدد لنفاوی که از تومورهای ریه تخلیه میشوند، با سلولهای دندریتیک مواجه میشوند و آنتیژنهای تومور نمایش داده شده توسط آن سلولها را تشخیص میدهند. با این حال، این سلول های T نتوانستند به طور کامل فعال شوند، در نتیجه مهار توسط جمعیت دیگری از سلول های T به نام سلول های T تنظیمی.
محققان دریافتند که این سلولهای T تنظیمکننده به شدت در غدد لنفاوی که از ریهها تخلیه میشوند فعال میشوند، اما نه در غدد لنفاوی نزدیک تومورهای واقع در پهلو. سلول های T تنظیمی معمولاً مسئول اطمینان از عدم حمله سیستم ایمنی به سلول های بدن هستند. با این حال، محققان دریافتند که این سلولهای T همچنین با توانایی سلولهای دندریتیک برای فعال کردن سلولهای T کشنده که تومورهای ریه را هدف قرار میدهند، تداخل دارند.
محققان همچنین کشف کردند که چگونه این سلولهای T تنظیمکننده سلولهای دندریتیک را سرکوب میکنند: با حذف پروتئینهای محرک از سطح سلولهای دندریتیک، که از فعال کردن فعالیت سلولهای T کشنده جلوگیری میکند.
تاثیر میکروبی
مطالعات بیشتر نشان داد که فعال شدن سلولهای T تنظیمی توسط سطوح بالای اینترفرون گاما در غدد لنفاوی که از ریهها تخلیه میشوند، انجام میشود. این مولکول سیگنالدهنده در پاسخ به حضور باکتریهایی که معمولاً بدون ایجاد عفونت در ریهها زندگی میکنند، تولید میشود.
محققان هنوز انواع باکتریهایی را که این پاسخ را القا میکنند یا سلولهایی که اینترفرون گاما را تولید میکنند شناسایی نکردهاند، اما نشان دادند که وقتی موشها را با آنتیبادی که اینترفرون گاما را مسدود میکند درمان کردند، میتوانند فعالیت سلولهای T کشنده را بازگردانند.
اینترفرون گاما اثرات مختلفی بر سیگنالدهی ایمنی دارد و مسدود کردن آن میتواند پاسخ ایمنی کلی در برابر تومور را کاهش دهد، بنابراین استفاده از آن برای تحریک سلولهای T کشنده استراتژی خوبی برای استفاده در بیماران نخواهد بود. آزمایشگاه او اکنون در حال بررسی راههای دیگری برای کمک به تحریک پاسخ سلولهای T کشنده است، مانند مهار سلولهای T تنظیمی که پاسخ سلولهای T کشنده را سرکوب میکنند یا سیگنالهای باکتریهای مشترک را مسدود میکنند، پس از اینکه محققان آنها را شناسایی کردند.
اطلاعات بیشتر:
ماریا زاگورولیا و همکاران، فراوانی بافت خاص اینترفرون گاما، سلولهای T تنظیمی را به مهار پرایمینگ سلولهای T سیتوتوکسیک با واسطه DC1 در برابر سرطان ریه سوق میدهد. مصونیت (2023). DOI: 10.1016/j.immuni.2023.01.010
ارائه شده توسط موسسه فناوری ماساچوست
این داستان با حسن نیت از MIT News (web.mit.edu/newsoffice/)، یک سایت محبوب که اخبار مربوط به تحقیقات، نوآوری و آموزش MIT را پوشش می دهد، بازنشر شده است.
نقل قول: چرا سرطان ریه به خوبی به ایمونوتراپی پاسخ نمی دهد (2023، 2 فوریه) در 2 فوریه 2023 از https://medicalxpress.com/news/2023-02-lung-cancer-doesnt-immunotherapy.html بازیابی شده است.
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
[ad_2]