[ad_1]
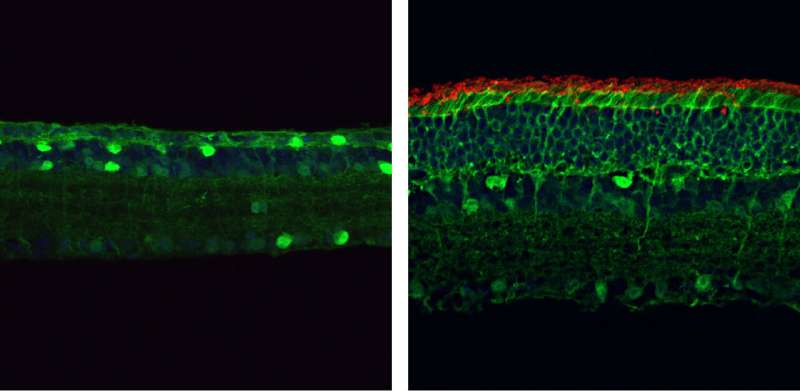
در سن چهار ماهگی، شبکیه موش های حامل جهش در ژن کد کننده PDE6β (سمت چپ) نازک هستند و فاقد گیرنده های نوری میله ای (قرمز) هستند. اما موش هایی که این جهش را از طریق سیستم PESpRY تصحیح کرده اند (سمت راست) شبکیه بسیار ضخیم تری دارند که حاوی سلول های میله ای متعدد است. اعتبار: © 2023 Qin et al. در ابتدا منتشر شد مجله پزشکی تجربی. DOI: 10.1084/jem.20220776
محققان چینی با موفقیت بینایی موشهای مبتلا به رتینیت پیگمانتوزا، یکی از علل اصلی نابینایی در انسان را بازیابی کردند. این مطالعه در 17 مارس در مجله منتشر خواهد شد مجله پزشکی تجربی، از یک فرم جدید و بسیار متنوع از ویرایش ژنوم مبتنی بر CRISPR با پتانسیل اصلاح طیف گسترده ای از جهش های ژنتیکی عامل بیماری استفاده می کند.
محققان قبلاً از ویرایش ژنوم برای بازیابی بینایی موشهای مبتلا به بیماریهای ژنتیکی مانند آموروز مادرزادی Leber استفاده کردهاند که بر اپیتلیوم رنگدانه شبکیه تأثیر میگذارد، لایهای از سلولهای غیر عصبی در چشم که از میلههای حسگر نور و سلولهای گیرنده نوری مخروطی پشتیبانی میکند. . با این حال، اکثر اشکال ارثی نابینایی، از جمله رتینیت پیگمانتوزا، ناشی از نقص ژنتیکی در گیرنده های نوری عصبی است.
کای یائو، استاد دانشگاه می گوید: «توانایی ویرایش ژنوم سلول های عصبی شبکیه، به ویژه گیرنده های نوری ناسالم یا در حال مرگ، شواهد بسیار قانع کننده تری برای کاربردهای بالقوه این ابزارهای ویرایش ژنوم در درمان بیماری هایی مانند رتینیت پیگمانتوزا ارائه می دهد. دانشگاه علم و صنعت ووهان
رتینیت پیگمانتوزا می تواند در اثر جهش در بیش از 100 ژن مختلف ایجاد شود و تخمین زده می شود که بینایی 1 نفر از 4000 نفر را مختل کند. این بیماری با اختلال عملکرد و مرگ سلولهای میلهای حساس به نور کم شروع میشود، قبل از گسترش به سلولهای مخروطی مورد نیاز برای دید رنگی، و در نهایت منجر به از دست دادن دید شدید و غیرقابل برگشت میشود.
یائو و همکارانش سعی کردند بینایی موشهای مبتلا به رتینیت پیگمانتوزا را که در اثر جهش در ژن کدکننده آنزیم حیاتی به نام PDE6β ایجاد شده بود، نجات دهند. برای انجام این کار، تیم Yao یک سیستم جدید و همه کاره CRISPR به نام PE را توسعه دادSpRY، که می تواند برای اصلاح بسیاری از انواع مختلف جهش ژنتیکی برنامه ریزی شود، صرف نظر از اینکه در کجای ژنوم رخ می دهد.
زمانی که برای هدف قرار دادن ژن PDE6β جهش یافته، PE برنامه ریزی شدSpRY این سیستم قادر به تصحیح موثر جهش و بازیابی فعالیت آنزیم در شبکیه موش بود. این کار از مرگ گیرنده های نوری میله ای و مخروطی جلوگیری کرد و پاسخ الکتریکی طبیعی آنها به نور را بازیابی کرد.
یائو و همکارانش آزمایشهای رفتاری مختلفی انجام دادند تا تأیید کنند که موشهای اصلاحشده ژنی بینایی خود را حتی تا سنین بالا حفظ کردند. برای مثال، حیوانات توانستند تقریباً مانند موشهای سالم و معمولی راه خود را از یک پیچ و خم آبی که با هدایت بصری هدایت میشد، پیدا کنند و در پاسخ به محرکهای بینایی، حرکات سر معمولی را نشان دادند.
یائو هشدار می دهد که هنوز کار زیادی باید انجام شود تا ایمنی و کارایی PE را ثابت کندSpRY سیستم در انسان یائو میگوید: «با این حال، مطالعه ما شواهد قابلتوجهی برای کاربرد in vivo این استراتژی جدید ویرایش ژنوم و پتانسیل آن در زمینههای مختلف تحقیقاتی و درمانی، بهویژه برای بیماریهای ارثی شبکیه مانند رتینیت پیگمانتوزا، ارائه میکند.
اطلاعات بیشتر:
Huan Qin و همکاران، نجات بینایی از طریق ویرایش اولیه in vivo بدون محدودیت در شبکیه عصبی در حال تخریب، مجله پزشکی تجربی (2023). DOI: 10.1084/jem.20220776
ارائه شده توسط انتشارات دانشگاه راکفلر
نقل قول: تکنیک جدید ویرایش ژن کاهش بینایی را در موش ها معکوس می کند (2023، 17 مارس) در 17 مارس 2023 از https://medicalxpress.com/news/2023-03-gene-editing-technique-reverses-vision-loss.html بازیابی شده است.
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
[ad_2]