[ad_1]
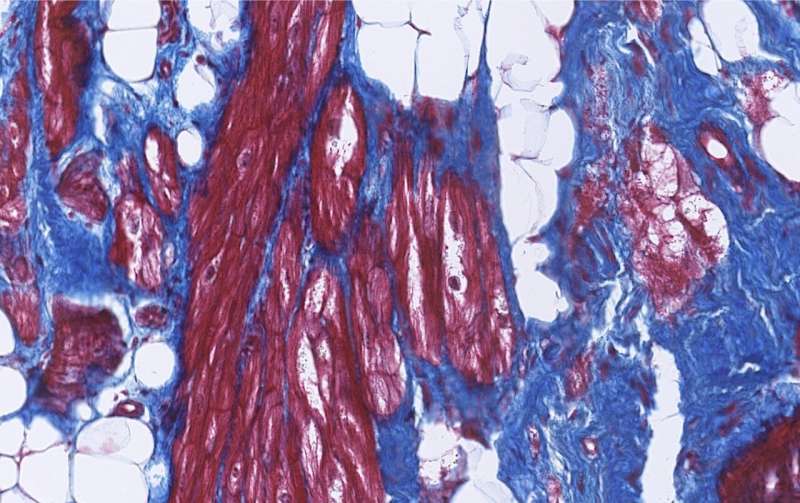
تکه های بافت فیبروز (آبی) و چربی (سفید) در قلب بیمار ACM. سلول های ماهیچه قلب به رنگ قرمز نشان داده شده اند. اعتبار: آریان وینک و پترا ون در کراک. حق چاپ: UMC Utrecht.
جهش در ژنهایی که دسموزوم را تشکیل میدهند، شایعترین علت بیماری قلبی کاردیومیوپاتی آریتموژنیک (ACM) است که از هر 2000 تا 5000 نفر در سراسر جهان یک نفر را مبتلا میکند. محققان گروه Eva van Rooij اکنون کشف کردند که چگونه یک جهش در ژن دسموزومی plakophilin-2 منجر به ACM می شود. آنها دریافتند که تغییرات ساختاری و عملکردی در قلب ACM ناشی از جهش پلاکوفیلین-2 نتیجه افزایش تخریب پروتئین دسموزومی است. یافته های این مطالعه، منتشر شده در پزشکی ترجمه علوم در 22 مارس 2023، درک ما از ACM را بیشتر کرد و میتواند به توسعه درمانهای جدید برای این بیماری کمک کند.
ACM یک بیماری قلبی پیشرونده و ارثی است که در حال حاضر هیچ درمانی برای متوقف کردن پیشرفت آن وجود ندارد. اگرچه بیماران در ابتدا هیچ علامتی را تجربه نمی کنند، اما در معرض خطر بالاتری از آریتمی و در نتیجه ایست قلبی ناگهانی هستند. با پیشرفت بیماری، تکه هایی از بافت فیبروتیک و چربی در قلب ایجاد می شود که می تواند منجر به نارسایی قلبی شود. در این مرحله بیماران به عنوان درمان نیاز به پیوند قلب دارند.
پلاکوفیلین-2
بیش از 50 درصد از موارد ACM ناشی از جهش در یکی از ژنهای دسموزومی است که با هم ساختارهای پروتئینی پیچیدهای به نام دسموسوم را تشکیل میدهند. دسموزوم ها بین سلول های عضله قلب منفرد “پل” ایجاد می کنند و به سلول ها اجازه می دهند به شیوه ای هماهنگ منقبض شوند. بیشتر جهشهای دسموزومی که باعث ACM میشوند در ژنی به نام پلاکوفیلین-2 رخ میدهند. با این وجود، اطلاعات کمی در مورد اینکه چگونه جهش در این ژن منجر به این بیماری می شود، شناخته شده است.
برای تغییر این وضعیت، آزمایشگاه Van Rooij ابتدا نمونههای قلب انسان را از بیماران ACM که دارای جهش در ژن پلاکوفیلین-2 بودند، مورد مطالعه قرار داد. Jenny (Hoyee) Tsui، نویسنده اول این مقاله میگوید: «ما شاهد سطوح پایینتری از پروتئینهای دسموزومی و پروتئینهای دسموسومی نامنظم در نواحی فیبروتیک قلبهای ACM بودیم. او گفت: «علاوه بر این، بافت ماهیچهای قلب سهبعدی کشتشده منشا گرفته از یک بیمار مبتلا به جهش پلاکوفیلین-2، قادر به ادامه ضربان با سرعتهای بالاتر، که شبیه آریتمیهایی است که در کلینیک دیده میشود، نبود.
ACM در موش ها
سپس محققان از یک ابزار ژنتیکی به نام CRISPR/Cas9 برای معرفی جهش پلاکوفیلین-2 انسانی در موشها برای تقلید ACM استفاده کردند. این به آنها اجازه داد تا پیشرفت بیماری را با جزئیات بیشتری مطالعه کنند. آنها مشاهده کردند که موشهای قدیمی ACM حامل این جهش، سطوح پایینتری از پروتئینهای دسموزومی و مشکلات آرامش قلب داشتند، مشابه بیماران ACM.
به طور شگفت انگیزی، محققان کشف کردند که این جهش سطوح پروتئین های دسموزومی را حتی در موش های جوان و سالمی که قلب آنها به طور طبیعی منقبض شده بود، کاهش داد. از این نتیجه آنها به این نتیجه رسیدند که از دست دادن پروتئین های دسموزومی می تواند زمینه ساز شروع ACM ناشی از جهش پلاکوفیلین-2 باشد.
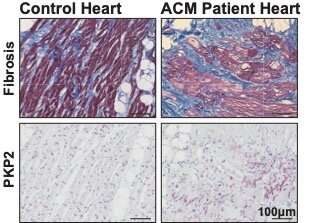
پلاکوفیلین-2 بهم ریخته (PKP2) در نواحی شدید فیبروتیک قلب بیماران ACM. پانل های بالایی بافت فیبروتیک (آبی)، بافت چربی (سفید) و سلول های عضله قلب (قرمز) قلب بیماران کنترل و ACM را نشان می دهد. پانل های پایینی محل پروتئین پلاکوفیلین-2 را در قلب یک فرد سالم و یک بیمار ACM نشان می دهد. اعتبار: پترا ون در کراک. حق چاپ: UMC Utrecht.
تخریب پروتئین
محققان سپس به توضیح از دست دادن پروتئین های دسموزومی پرداختند. برای این کار آنها هم سطح RNA و هم پروتئین را در موش های ACM خود مورد مطالعه قرار دادند. سباستین ون توضیح می دهد: “سطح پروتئین های دسموزومی در موش های ACM ما در مقایسه با موش های کنترل سالم کمتر بود. با این حال، سطح RNA این ژن ها بدون تغییر بود. ما کشف کردیم که این یافته های شگفت انگیز نتیجه افزایش تخریب پروتئین در قلب ACM است.” کامپن، نویسنده اول مقاله.
Tsui می افزاید: “وقتی ما موش های ACM خود را با دارویی درمان کردیم که از تخریب پروتئین جلوگیری می کند، سطح پروتئین های دسموسومی بازیابی شد. مهمتر از آن، سطوح ترمیم شده پروتئین های دسموسومی باعث بهبود مدیریت کلسیم سلول های عضله قلب شد که برای عملکرد طبیعی آنها حیاتی است. ”
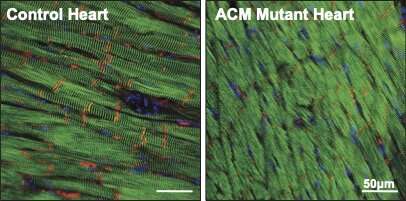
سطح پلاکوفیلین-2 (قرمز) در قلب موش های ACM در مقایسه با موش های کنترل سالم کاهش می یابد. سلول های عضله قلب به رنگ سبز و هسته های سلولی با رنگ آبی نشان داده شده اند. اعتبار: جنی (هوی) تسویی. حق چاپ: موسسه هوبرشت
به سوی درمان های جدید
نتایج این مطالعه بینش جدیدی را در مورد توسعه ACM ایجاد می کند و نشان می دهد که تخریب پروتئین می تواند یک هدف جالب برای درمان های آینده باشد.
Eva van توضیح می دهد: “تجزیه پروتئین در هر سلول بدن ما اتفاق می افتد و برای عملکرد این سلول ها بسیار مهم است. برای غلبه بر عوارض جانبی درمان های آینده، ما نیاز به توسعه داروهایی داریم که به طور خاص از تخریب پروتئین های دسموزومی در سلول های عضله قلب جلوگیری می کند.” Rooij، رهبر گروه در مؤسسه Hubrecht و آخرین نویسنده این مطالعه. بنابراین تحقیقات بیشتری برای درک این موضوع مورد نیاز است. در آینده، این داروهای خاص جدید می توانند به طور بالقوه برای متوقف کردن شروع و جلوگیری از پیشرفت ACM مورد استفاده قرار گیرند.
اطلاعات بیشتر:
Hoyee Tsui و همکاران، تخریب پروتئین دسموزومی به عنوان یک علت زمینه ای کاردیومیوپاتی آریتموژنیک، پزشکی ترجمه علوم (2023). DOI: 10.1126/scitranslmed.add4248. www.science.org/doi/10.1126/scitranslmed.add4248
ارائه شده توسط موسسه Hubrecht
نقل قول: از جهش تا آریتمی: تجزیه پروتئین دسموزومی به عنوان مکانیسم اساسی بیماری قلبی (2023، 22 مارس) در 23 مارس 2023 از https://medicalxpress.com/news/2023-03-mutation-arrhythmia-desmosomal-down-protein- بازیابی شده است. .html
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
[ad_2]