[ad_1]
اعتبار: سلول (2023). DOI: 10.1016/j.cell.2023.02.023
درست مانند هرس درخت به رشد مناسب کمک می کند، مغز نیز از هرس سیناپسی برای خلاص شدن از شر اتصالات غیر ضروری بین سلول های خود استفاده می کند. با این حال، زمانی که این روند طبیعی که بین اوایل کودکی و بزرگسالی اتفاق می افتد، به درستی متوقف نشود، مغز بسیاری از ارتباطات، از جمله ارتباطات مهم را از دست می دهد. به دلیل این هرس بیش از حد، برخی از سلول های مغز می میرند و برخی دیگر باعث التهاب می شوند که منجر به مشکلاتی در حرکت، تفکر و یادگیری می شود.
در یک مطالعه پیشگامانه که به تازگی منتشر شده است، یک تیم تحقیقاتی از موسسه تحقیقاتی مرکز بهداشت دانشگاه مک گیل (RI-MUHC) و موسسه لیدی دیویس (LDI) در بیمارستان عمومی یهودی متوجه شدند که چگونه این فرآیند معیوب رخ می دهد.
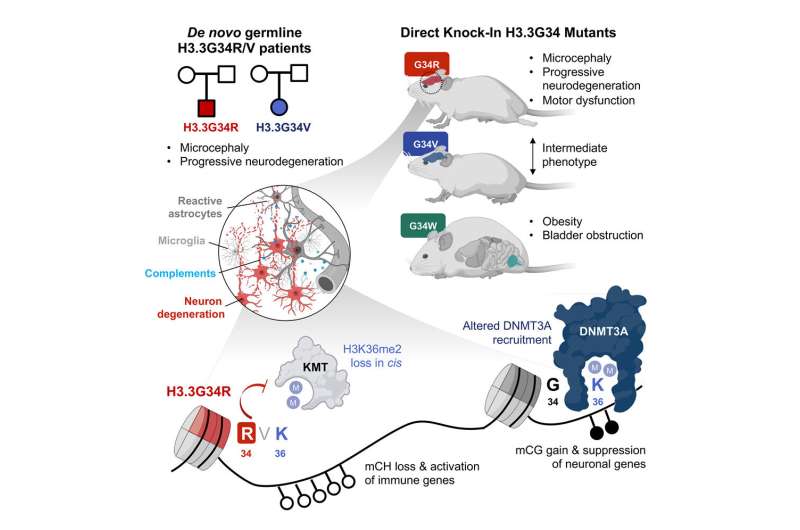
با بررسی پیامدهای رشدی سه جهش خاص هیستونی (H3.3G34R، V و W)، محققان به رهبری دکتر نادا جابادو و دکتر لیویا گارزیا در RI-MUHC، همراه با دکتر کلودیا کلاینمن در LDI، یک مکانیسم ژنتیکی که منجر به سندرم های عصبی رشدی شدید می شود. به طور خاص، آنها کشف کردند که چگونه مغز در بیماری های ناشی از این جهش های مولد آسیب می بیند – جهش هایی که در سلول های تولید مثلی وجود دارند و در DNA هر سلول گنجانده می شوند.
یافته های آنها در مجله منتشر شده است سلول، نه تنها می تواند به دانشمندان در یافتن راه های جدید برای درمان این بیماری ها کمک کند، بلکه می تواند به مطالعه سایر بیماری های عصبی که شامل از دست دادن سلول های مغز و التهاب و التهاب هستند، مانند آلزایمر، و همچنین اختلالاتی که در آنها مشکوک به هرس بیش از حد است، مانند اسکیزوفرنی، کمک کند. .
دکتر جابادو میگوید: “نرونها را نمیتوان جایگزین کرد. یافتن مکانیسمهایی که ممکن است بر آنها تأثیر بگذارد مهم است و دری را به روی مداخلات درمانی که به شدت مورد نیاز هستند، هم برای مهار التهاب قبل از مهم شدن از دست دادن نورون و هم برای مهار بیماری در دراز مدت باز میکند.” ، دانشمند ارشد در برنامه سلامت کودک و توسعه انسانی در RI-MUHC و استاد گروه اطفال در دانشگاه مک گیل.
دکتر کلینمن، دانشیار ژنتیک انسانی در دانشگاه مک گیل و محقق اصلی LDI میافزاید: «تخریب عصبی یکی از مسائل مهمی است که با افزایش سن با آن مواجه میشویم». هر گونه بینش جدید استقبال می شود زیرا نیازها بسیار زیاد است و یافته های ما ممکن است نور دیگری را بر این مشکل ویرانگر روشن کند.
پایدار به جای هرس گذرا
این مطالعه نشان میدهد که جهشهای خاص در ژنهای هیستون منجر به کاهش بیان «فانوس دریایی» در مناطق خاصی از کروماتین (مخلوطی از DNA و پروتئینهایی که کروموزومها را تشکیل میدهند) میشود. این چراغها معمولاً DNMT3A را جذب میکنند، آنزیمی که میتواند ژنها را بسته به مناطق رسوبگذاری، خاموش یا فعال کند. کاهش آنها به ژن ها اجازه می دهد تا به تولید پروتئین هایی ادامه دهند که به فرآیند هرس سیناپسی کمک می کند. بنابراین، هرس که باید متوقف می شد ادامه دارد و باعث آسیب مغزی می شود.
دکتر لیویا گارزیا، دانشمندی در این زمینه توضیح میدهد: «ما میدانستیم که سندرمهای عصبی رشدی شدید، که با مغز کوچکتر، مشکل در راه رفتن، غذا خوردن و صحبت کردن، و همچنین مشکل در یادگیری مرتبط هستند، به دلیل جهشهای مولفه خاصی در هیستونها ایجاد میشوند.» برنامه تحقیقات سرطان در RI-MUHC و استادیار گروه جراحی در دانشگاه مک گیل. در این مطالعه، ما نشان دادیم که چه اتفاقی میافتد وقتی هیستونها نمیتوانند کار خود را به درستی انجام دهند و به مغز اجازه میدهند پروتئینهای التهابی بیشتری از حد مورد نیاز بسازد و باعث تخریب پیشرونده عصبی شود.
همه چیز از دو بیمار شروع شد
تیم دکتر جابادو یک بیمار مبتلا به جهش de novo (که از والدینش به ارث برده نشده است) در H3.3G34R شناسایی کردند. بیمار ویژگی های مشترکی را با بیمار دیگری که دارای جهش در H3.3G34V بود نشان داد. هر دو بیمار از بدو تولد دارای تاخیر رشد عصبی شدیدی بودند که در طول رشد پس از تولد بدتر شد. در 2 سالگی نیز تاخیر رشد شدید و میکروسفالی داشتند.
هر دو بیمار علائم بالینی دیگری مانند مشکلات تغذیه، حرکات مکرر دست و صرع مقاوم به دارو داشتند و هیچ یک از آنها قادر به راه رفتن یا صحبت کردن نبودند که نشان میدهد خط مولد H3.3G34R/V به شدت رشد مغز و شناخت عصبی آنها را مختل کرده است. دکتر جابادو، که هماتوآنکولوژیست کودکان در بیمارستان کودکان مونترال MUHC است، توضیح می دهد. با این حال، بیمار G34R یک رگرسیون رشدی مشخص را نشان داد که با از دست دادن توانایی نشستن و همچنین کاهش تعامل اجتماعی نشان داده شد.
مشاهدات مجزا برای هر جهش
برای درک پیامدهای رشدی جهشهای H3.3G34، محققان موشهایی را با جهشهای G34R، V و W با استفاده از ویرایش جنین مهندسی کردند.
در مقاله مطالعه، محققان گزارش کردند که اختلالات عصبی در موش ها در دوران نوجوانی و اوایل بزرگسالی ظاهر می شود و به تدریج با افزایش سن بدتر می شود. آنها همچنین خاطرنشان کردند که جهشهای G34R، V و W اساساً به روشهای متفاوتی بر رشد مغز تأثیر میگذارند. برای مثال:
- جهش G34R بافت هایی با منشا متفاوت از G34W را تحت تاثیر قرار داد.
- موشهای G34R تغییرات عصبی شدیدی را نشان دادند، در حالی که موشهای G34W دارای نقصهای مثانه، حالب- تناسلی و چاقی مرضی بودند.
- موش های G34R، اما نه G34W، عملکردهای حرکتی مختلی را نشان دادند.
- آتاکسی، وضعیتی که به دلیل کنترل ضعیف عضلات بر هماهنگی، تعادل و گفتار تأثیر می گذارد، موش های G34R را به شدت تحت تأثیر قرار داد و باعث مرگ آنها شد. موشهای G34V را تا حدودی تحت تأثیر قرار داد اما در مدلهای G34W وجود نداشت.
- جهش G34R، و به میزان کمتر G34V اما نه G34W، میکروسفالی پیشرونده را القا کردند.
دکتر جابادو میگوید: «در تحقیقات خود، ما توانستیم تفاوتهای رشدی قابلتوجهی را در جهشهای H3.3G34R، V و W تشخیص دهیم، که یادآور ویژگی مشاهدهشده در بیماران مبتلا به بیماریهای جهش یافته H3.3G34 است». “ما اختلالات اپی ژنتیکی با واسطه G34R را در مغز در حال توسعه روشن کردیم، که به طور بالقوه زمینه ساز نقایص عصبی منحصر به فرد این جهش است.”
دریافت داستان کامل از ژن به فنوتیپ
این تیم از محققان در سطح بین المللی به دلیل کار خود بر روی سرطان و تومورهای مغزی، به ویژه بر روی جهش در ژن های هیستون، شهرت دارند و در این زمینه بود که آنها ابتدا در حال مطالعه جهش های H3.3G34 در آزمایشگاه بودند. در یک نقطه، آنها به طور تصادفی با موش هایی برخورد کردند که یک فنوتیپ (مجموعه ای از ویژگی ها) از تخریب عصبی را برای یک جهش یافته خاص نشان می دادند و بیمارانی را که دچار تخریب عصبی بودند که علائم مشابهی داشتند، کشف کردند.
دکتر توضیح میدهد: «ما نمیتوانستیم بر اساس شدت و قانعکننده بودن این فنوتیپ رها کنیم. علاوه بر این، این واقعیت که این جهش ممکن است در رده زایا نیز رخ دهد و به شدت کودکان را تحت تأثیر قرار دهد و آینده آنها را نفی کند، یک انگیزه بزرگ برای حرکت به جلو بود». جابادو.
سیما خزایی، دانشجوی کارشناسی ارشد آزمایشگاه دکتر جابادو، در این پیشرفت بسیار مهم بود. او با سخت کوشی، زیرکی و پشتکار، تیم را رهبری کرد تا بفهمد چرا آنها این فنوتیپ را می بینند. پاسخ زمانی رسید که همه – دکتر. جابادو، گارزیا و کلینمن، و همچنین اولین نویسندگان همکار سیما خزایی، کارول سیال چن و آگوستو فاریا آندراد هر کدام بخشی از پازل را ارائه کردند و دادههایی را تأیید کردند که این آبشار از وقایع را واقعی و بالقوه در جاهای دیگر قابل اجرا کرد.
ما به این کار افتخار می کنیم، نه تنها به دلیل یافته ها، بلکه به دلیل رویکردی که برای کشف مکانیسم های بیماری و ابزارهایی که در اختیار جامعه علمی قرار داده ایم، که هر دو ارزشمند هستند و می توان برای مطالعه به کار برد. دکتر کلاینمن می گوید: چندین نوع اختلال مغزی.
اطلاعات بیشتر:
سیما خزایی و همکاران، جایگزینی منفرد در H3.3G34، جذب DNMT3A را تغییر میدهد تا باعث تخریب پیشرونده عصبی شود. سلول (2023). DOI: 10.1016/j.cell.2023.02.023
سلول
ارائه شده توسط مرکز بهداشت دانشگاه مک گیل
نقل قول: هرس بیش از حد: یک مطالعه جدید چگونگی رخ دادن تخریب عصبی در مغز را روشن می کند (2023، 23 مارس) که در 23 مارس 2023 از https://medicalxpress.com/news/2023-03-pruning-neurodegeneration-brain.html بازیابی شده است.
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
[ad_2]