[ad_1]
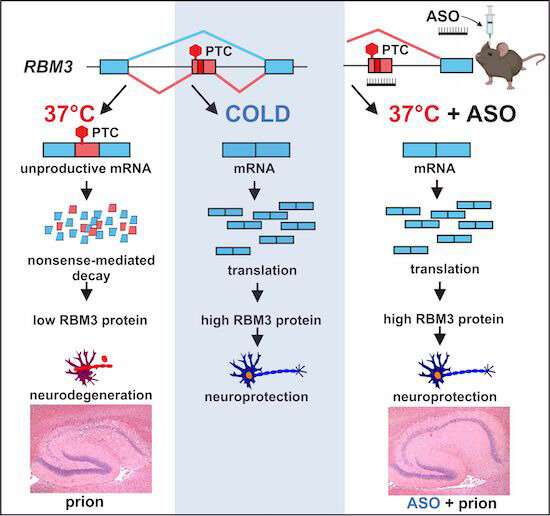
پیوند جایگزین همراه با پوسیدگی با واسطه بی معنی برای کنترل بیان پروتئین محافظت کننده عصبی RBM3 ناشی از سرما نشان داده شده است. القای RBM3 با تعدیل اتصال جایگزین آن از طریق ASOs در نورموترمی، محافظ عصبی در داخل بدن است و پتانسیل درمانی بالایی دارد. اعتبار: پزشکی مولکولی EMBO (2023). DOI: 10.15252/emmm.202217157
دانشمندان در کمبریج و برلین از نوعی ژن درمانی برای افزایش سطوح به اصطلاح “پروتئین شوک سرد” در مغز موش ها استفاده کرده اند و از آنها در برابر تأثیر بالقوه ویرانگر بیماری پریون محافظت می کند.
این کشف گامی به سوی استفاده از اثرات محافظتی خنک کردن مغز برای درمان بیماران مبتلا به آسیب مغزی حاد و حتی برای جلوگیری از زوال عقل مانند آلزایمر است.
هنگامی که بدن به طور قابل توجهی خنک می شود، سطح RBM3 خود را افزایش می دهد، مولکولی که به عنوان پروتئین شوک سرد شناخته می شود – پدیده ای که برای اولین بار در حیوانات در خواب زمستانی مشاهده شد. تصور می شود که در طول خواب زمستانی، این پروتئین به محافظت از مغز در برابر آسیب کمک می کند و به آن اجازه می دهد تا به ایجاد اتصالات جدید ادامه دهد.
در سال 2015، پروفسور جیوانا مالوچی و همکارانش در موشها نشان دادند که RBM3 میتواند از مغز در برابر آسیبهای مرتبط با تجمع پروتئینهای تاشو نادرست محافظت کند، که میتواند منجر به اشکال مختلف زوال عقل، مانند بیماری آلزایمر و پارکینسون و بیماریهای پریونی مانند بیماری کروتسفلد جاکوب (CJD).
هیپوترمی القایی برای درمان بیماران در بخشهای مراقبتهای ویژه – از جمله نوزادان تازه متولد شده و بیماران آسیبدیدگی مغزی – بهکار میرود که بیماران در کما قرار میگیرند و مغز آنها خنک میشود تا در برابر آسیب محافظت شود. اما این با خطرات مرتبطی مانند لخته شدن خون و ذات الریه همراه است. آیا می توان از پروتئین شوک سرد برای درمان بیماران بدون نیاز به خنک کردن بدن استفاده کرد، درمان ایمن تری برای آسیب مغزی حاد یا راهی برای محافظت از مغز در برابر زوال عقل ارائه کرد؟
در تحقیقات منتشر شده در پزشکی مولکولی EMBOدانشمندان مؤسسه تحقیقاتی زوال عقل بریتانیا، دانشگاه کمبریج، و مؤسسه شیمی و بیوشیمی، دانشگاه فرای برلین، مطالعه کردند که آیا نوعی از ژن درمانی به نام الیگونوکلئوتیدهای آنتی سنس (ASOs) می تواند سطوح پروتئین شوک سرما را در مغز افزایش دهد یا خیر. از موش ها – و از این رو از آنها محافظت کنید.
این تیم ژنی را که برای تولید پروتئین شوک سرد کد می کند بررسی کردند و دریافتند که حاوی عنصر کلیدی است که در شرایط عادی از بیان آن جلوگیری می کند. حذف، یا “شماره گیری” این عنصر با استفاده از ASO، منجر به افزایش طولانی مدت تولید RBM3 می شود.
برای آزمایش اینکه آیا این رویکرد می تواند از مغز محافظت کند، محققان از موش های آلوده به پریون استفاده کردند. به برخی از این موش ها سه هفته بعد یک دوز ASO تزریق شد، در حالی که به بقیه یک درمان کنترلی داده شد.
دوازده هفته پس از تجویز پریونها، موشهایی که درمان کنترل را دریافت کرده بودند به بیماری پریون تسلیم شدند و نورونهای زیادی را در هیپوکامپ، ناحیهای از مغز که برای حافظه مهم است، از دست دادند.
داستان برای موش هایی که ASO دریافت کرده بودند بسیار متفاوت بود. همزمان با تسلیم شدن سایر موشها به بیماری پریون، سطح RBM3 در موشهای تحت درمان با ASO دو برابر بیشتر از موشهای دیگر بود. هفت موش از هشت موش تحت درمان با ASO حفظ گسترده نورونها را در هیپوکامپ نشان دادند.
پروفسور جیووانا مالوچی، که این کار را در زمانی که در مؤسسه تحقیقاتی زوال عقل بریتانیا در دانشگاه کمبریج رهبری می کرد، گفت: “در اصل، پروتئین شوک سرد مغز را قادر می سازد از خود محافظت کند – در این مورد، در برابر آسیب به سلول های عصبی در مغز. در طول بیماری پریون. به طور قابل توجهی، ما نشان دادیم که تنها یک تزریق با ASO برای محافظت طولانی مدت برای این موش ها کافی است و از پیشرفت اجتناب ناپذیر تخریب عصبی جلوگیری می کند.
پروفسور فلوریان هید از دانشگاه فرای برلین افزود: “این رویکرد امکان محافظت در برابر بیماری هایی مانند آلزایمر و بیماری پارکینسون را ارائه می دهد که ما هیچ درمان پیشگیرانه قابل اعتمادی برای آنها نداریم.
ما هنوز از این مرحله فاصله داریم زیرا کارمان روی موش ها بود، اما اگر بتوانیم با خیال راحت از ASO برای تقویت تولید پروتئین شوک سرما در انسان استفاده کنیم، ممکن است بتوان از زوال عقل جلوگیری کرد. ما در حال حاضر شاهد استفاده از ASO هستیم. برای درمان موفقیت آمیز آتروفی عضلانی نخاعی و اخیرا مجوز درمان بیماری نورون حرکتی را دریافت کرده اند.”
اگر بتوان این یافته ها را در انسان نیز تکرار کرد، این رویکرد می تواند پیامدهای عمده ای برای درمان بیماران فراتر از تخریب عصبی داشته باشد. این موارد شامل آسیب مغزی حاد نوزادان مبتلا به هیپوکسی از طریق محافظت از مغز در جراحی قلب، سکته مغزی و آسیب سر در بزرگسالانی است که در غیر این صورت با هیپوترمی درمانی درمان میشوند.
اطلاعات بیشتر:
Marco Preußner و همکاران، ASO با هدف قرار دادن اتصال اگزون سمی کنترل شده با دمای RBM3 از تخریب عصبی در داخل بدن جلوگیری می کند. پزشکی مولکولی EMBO (2023). DOI: 10.15252/emmm.202217157
ارائه شده توسط دانشگاه کمبریج
نقل قول: تقویت پروتئین شوک سرمایی در مغز بدون خنک کردن موشها را در برابر بیماریهای عصبی محافظت میکند (2023، 24 مارس) بازیابی شده در 24 مارس 2023 از https://medicalxpress.com/news/2023-03-boosting-cold-protein-brain- خنک کننده.html
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
[ad_2]