[ad_1]
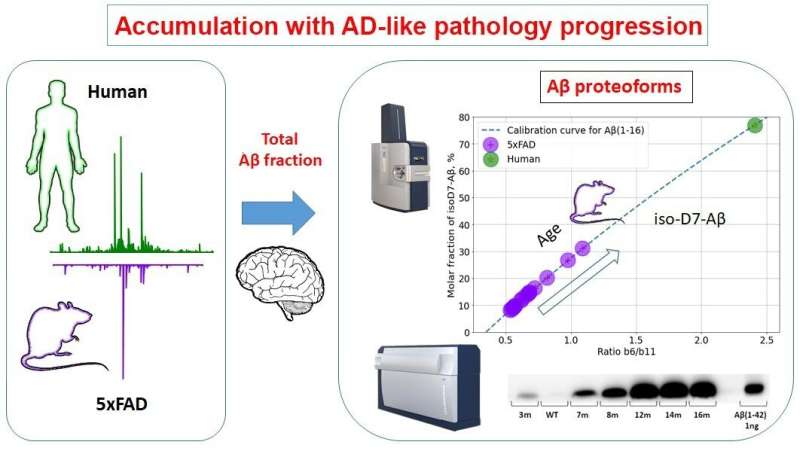
طرح آزمایشی و نتایج مطالعه: موش های تراریخته با پلاک های بتا آمیلوئید شبیه بیماری آلزایمر در مغز. درجه ایزومریزاسیون پپتیدهای بتا آمیلوئید (عمودی) با شدت سیگنال طیف سنجی جرمی (افقی) تعیین می شود. نتایج به دست آمده برای مغز انسان (نقطه سبز) با نتایج به دست آمده برای مغز موش های تراریخته (نقاط بنفش) مطابقت دارد. اعتبار: الکسی کونیخین
گروهی از دانشمندان Skoltech به سرپرستی پروفسور Evgeny Nikolaev با همکاری همکارانی از MIPT، موسسه زیستشناسی مولکولی Engelhardt از RAS، و Emanuel Institute of Biochemical Physics of RAS، نحوه کمک تکنیکهای طیفسنجی جرمی به مطالعه تنوع پپتیدهای بتا آمیلوئید را بررسی کردهاند. که از بیومارکرهای اصلی بیماری آلزایمر هستند. مقاله آنها که خلاصهای از دستاوردهای اخیر در این منطقه است در منتشر شد بررسی طیف سنجی جرمی و به مطالعه قبلی محققان اشاره می کند که در آن آنها یک محرک بالقوه جدید برای تشکیل سریع پلاک های آمیلوئیدی در مغز پیدا کردند که یکی از علل آلزایمر در نظر گرفته می شود. فن آوری های جدید مبتنی بر ام اس باید به درک بهتر پاتوژنز بیماری، تشخیص آن در مراحل اولیه، پیش بینی خطرات و ایجاد رویکردهای درمانی موثرتر کمک کند.
بیماری آلزایمر علت اصلی زوال عقل و مهمترین اختلال عصبی از نظر اجتماعی در میان سالمندان است. AD با رسوب پپتیدهای بتا آمیلوئید به شکل پلاک های پیری مشخص می شود. اگرچه مکانیسم این بیماری هنوز به طور کامل شناخته نشده است، اما دانشمندان بر این باورند که تشکیل پلاک یکی از علل آن است.
پپتیدهای بتا آمیلوئید (Aβ) با بریدن تکه هایی که 39 تا 42 بقایای اسید آمینه طولی از پروتئین پیش ساز آمیلوئید نامیده می شود، که در غشای سلولی قرار دارد، تشکیل می شوند. ایزوفرم های پپتید Aβ حاصل از نظر طول متفاوت بوده و خواص بیوشیمیایی متفاوتی دارند. علاوه بر طول آنها، پپتیدها به دلیل تغییرات پس از ترجمه یا PTMها نیز متفاوت هستند. اینها تغییراتی هستند که بر خواص شیمیایی اسیدهای آمینه تأثیر می گذارند که پس از سنتز پروتئین رخ می دهد. به نظر می رسد که برخی از PTM ها پپتیدهای Aβ را ایجاد می کنند که به ویژه مستعد تشکیل پلاک هستند – این پپتیدها در غلظت های بالایی در پلاک های پیری بیماران AD یافت می شوند.
نظارت بر تنوع پپتیدهای Aβ ممکن است به تشخیص دقیقتر بیماری و مراقبت از پیشرفت آن کمک کند. طیف سنجی جرمی دقیق ترین و دقیق ترین روش برای تجزیه و تحلیل انواع مختلف پپتیدهای بتا آمیلوئید است.
یکی از نویسندگان، محقق ارشد Skoltech، Alexey Kononikhin، توضیح می دهد: “ما می خواستیم قابلیت های روش های طیف سنجی جرمی برای بررسی و تشخیص بیماری آلزایمر را برجسته کنیم. در مقاله مروری، ما دستاوردهای خود و سایر گروه ها را در این زمینه ارائه می دهیم.” . طیف سنجی جرمی به ما اجازه داد تا به سطح جدیدی از درک پیچیدگی پپتیدهای بتا آمیلوئید برسیم، که در انواع زیادی از ایزوفرم ها در سراسر بدن وجود دارد. ما نشان دادیم که ترکیب آنها در بیماری آلزایمر تغییر می کند و برخی ایزوفرم های پپتیدها را شناسایی کردیم. به عنوان مثال، در نمونه خون یک بیمار – حتی می تواند پیش بینی اولیه AD را امکان پذیر کند.
طیف سنجی جرمی یک تکنیک تحلیلی است که به طور گسترده برای تجزیه و تحلیل پپتیدها و پروتئین ها استفاده می شود. این اطلاعات در مورد ترکیب یک نمونه بیولوژیکی در قالب یک طیف جرمی ارائه می دهد که منعکس کننده فراوانی نسبی اجزا با جرم های مختلف، یا به عبارت دقیق تر، با نسبت جرم به بار متفاوت است. از آنجایی که آمینو اسیدها از نظر جرم متفاوت هستند، اندازه گیری دقیق توده پپتیدها و قطعات آن ها تشخیص یک پپتید Aβ از دیگری و حتی تشخیص PTM ها را ممکن می سازد.
“به لطف طیف سنجی جرمی، تنوع اشکال مختلف این پپتیدها تایید شده است. این درک و دید ما را از آنچه اتفاق می افتد گسترش می دهد: ما نه تنها تعداد زیادی از پپتیدهای Aβ، بلکه یک تصویر پیچیده کامل را می بینیم. روش نه تنها به خوبی کار می کند. برای درک پاتوژنز آلزایمر و همچنین برای تشخیص بهتر، به ویژه در مراحل اولیه.”
بر خلاف PTM های معمول، ایزومریزاسیون اسید آمینه، که برای AD اهمیت ویژه ای دارد، جرم پپتید را تغییر نمی دهد و بنابراین، تشخیص حضور آن دشوارتر است. در مورد پپتیدهای بتا آمیلوئید، ایزومریزاسیون خود به خودی هفتمین اسید آمینه در توالی – باقی مانده آسپارتات – از اهمیت ویژه ای برخوردار است. این تغییر اغلب در پلاک های بیماران مبتلا به AD وجود دارد و یک محرک بالقوه برای تجمع Aβ در نظر گرفته می شود.
“ما یک روش طیف سنجی جرمی کمی را برای تشخیص ایزومریزاسیون توسعه دادیم و تجمع دینامیکی اشکال پپتیدی را مورد مطالعه قرار دادیم. ما برای اولین بار پپتیدهای بتا آمیلوئید را از بافت مغز AD انسان و موش های تراریخته با علائم مشابه AD مقایسه کردیم. ما دیدیم که درجه ایزومریزاسیون پپتید Aβ در پلاک ها با افزایش سن موش افزایش می یابد و دینامیک این تجمع بسیار جالب است مثلاً از ماه هفتم محتوای فرم ایزومریزه شده افزایش می یابد و از 10 ماهگی خود پلاک ها به سرعت تشکیل می شوند. بنابراین یافتههای ما تا حدی این فرضیه را تأیید میکند که ایزومریزاسیون ممکن است به عنوان محرکی برای تشکیل پلاک عمل کند، اما شواهد تجربی بیشتری مورد نیاز است.»
این نتایج نشان میدهد که مطالعات طیفسنجی جرمی پلاکهای AD میتواند به ابزاری مؤثر با حساسیت و ویژگی بالا تبدیل شود که هم برای اعتبارسنجی نتایج بهدستآمده از روشهای دیگر و هم برای کشف اشکال جدید پپتیدهای Aβ مناسب است. تجزیه و تحلیل اینکه چگونه محتوای آنها متفاوت است برای روشن کردن پاتوژنز بیماری آلزایمر، پیشبینی خطر شروع آن و توسعه درمان مؤثر اهمیت ویژهای دارد.
مولکول پاتولوژی های متعدد مرتبط با بیماری آلزایمر را کاهش می دهد
Natalia V. Zakharova و همکاران، مطالعات طیف سنجی جرمی انواع پروتئوفرم های بتا آمیلوئید در بیماری آلزایمر، بررسی طیف سنجی جرمی (2022). DOI: 10.1002/mas.21775
ارائه شده توسط موسسه علم و فناوری Skolkovo
نقل قول: طیف سنجی جرمی برای تشخیص نشانگرهای کلیدی آلزایمر (2022، 19 مه) در 19 مه 2022 از https://medicalxpress.com/news/2022-05-mass-spectrometry-key-markers-alzheimer.html بازیابی شده است.
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
[ad_2]