[ad_1]
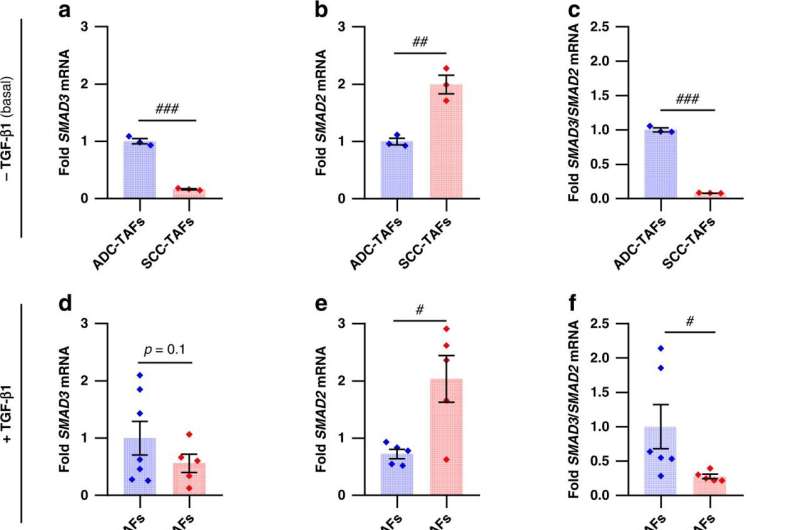
مدلهای ژنتیکی برای تقلید تغییرات SMAD2/3 در ADC-TAF و SCC-TAF مشتق شده از بیمار. a-c، SMAD3 (a) و SMAD2 (b) mRNA و نسبت متناظر (c) در TAFs ریه اولیه که به مدت 3 روز در شرایط پایه (یعنی بدون TGF-β1 اگزوژن) به صورت 2 بعدی کشت شده اند (3 ADC، 3 SCC) تا کنید. d-f، SMAD3 (d) و SMAD2 (e) mRNA و نسبت متناظر (f) در TAFهای ریه اولیه که در 2 بعدی به مدت 3 روز در حضور 2.5 نانوگرم در میلی لیتر TGF-β1 (7 ADC، 5 SCC) کشت داده شدند. g، نماینده وسترن بلات برای کل SMAD2، SMAD3 و β-اکتین ADC-TAFs و SCC-TAFs از بیماران به طور تصادفی انتخاب شده در 0 دقیقه یا 30 دقیقه پس از تحریک با TGF-β1. h، i، تجزیه و تحلیل تراکم نسبت کل SMAD3/SMAD2 در TAF از بیمارانی که به طور تصادفی انتخاب شده اند (3 ADC، 3 SCC) در 0 دقیقه (ساعت) یا 30 دقیقه (i) پس از تحریک با TGF-β1. j-l، SMAD3 (j)، SMAD2 (k) و نسبت mRNA ژن SMAD3/SMAD2 (l) از فیبروبلاست های کنترل shControl، shSMAD2 و shSMAD3 از بیمار شماره 5 که به مدت 3 روز در شرایط پایه در 2 بعدی کشت شدند. m، نماینده وسترن بلات برای کل SMAD2، SMAD3 و β-اکتین فیبروبلاست های کنترل shControl، shSMAD2 و shSMAD3 (#5) در شرایط پایه. نوارهای خطا نشان دهنده میانگین ± sem هر نقطه مربوط به بیمار متفاوتی است (a–i). #p کمتر از 0.05 است. ##p کمتر از 0.01 است. ###p در مقایسه با ADC-TAF و SCC-TAF یا shSMAD2 و shSMAD3 کمتر از 0.005 است. **p کمتر از 0.01 است. ***p با توجه به shControl کمتر از 0.005 است. مقایسات آماری با استفاده از آزمون t Student انجام شد. اعتبار: مجله سرطان بریتانیا (2022). DOI: 10.1038/s41416-022-02093-x
تیمی از متخصصان از دانشگاه بارسلونا، دانشگاه ساراگوسا و بیمارستان کلینیک بارسلونا مکانیسمی برای جذب سلولهای مرتبط با تومور (فیبروبلاستهای مرتبط با سرطان یا CAFs) پیدا کردهاند که برای آدنوکارسینوم ریه، شایعترین نوع، ضروری هستند. از سرطان این سلول های مرتبط با سرطان در تمام مراحل رشد تومور، از جمله متاستاز، نقش دارند.
این مطالعه، منتشر شده در مجله سرطان بریتانیانشان میدهد که نوعی داروی بازدارنده وجود دارد که میتواند در برابر مزیت مهاجرتی این سلولهای مرتبط با سرطان مفید باشد و بنابراین میتواند از جذب آنها و در نتیجه مشارکت آنها در توسعه تومور جلوگیری کند.
جوردی آلکاراز، هماهنگ کننده این مطالعه، می گوید: اهمیت این یافته ها در این است که آدنوکارسینوم ریه 40 درصد از موارد سرطان ریه را تشکیل می دهد و متاستاز اولیه ایجاد می کند که مستقیما بر شانس بقای بیماران تأثیر می گذارد. عضو دانشکده پزشکی و علوم بهداشت UB و موسسه مهندسی زیستی کاتالونیا (IBEC)، در حال حاضر، نرخ بقای پنج ساله برای سرطان ریه که به سایر اندامها گسترش نیافته است بیش از 60 درصد است. با این حال، هنگامی که به سایر قسمت های بدن گسترش می یابد، این شانس به زیر 10٪ کاهش می یابد.
چگونه پروتئین SMAD3 بر روند تومور تأثیر می گذارد؟
آلکاراز در مطالعات قبلی دریافت که پروتئین SMAD3 به طور انتخابی در بیماران مبتلا به آدنوکارسینوم بیش فعال می شود. اکنون، مطالعه جدید که همراه با دانشگاه ساراگوسا انجام شده است، اثرات پروتئین SMAD3 را در جذب سلول های مرتبط با سرطان تجزیه و تحلیل می کند و تاثیر آن را در انتشار تومور و تولید متاستاز تجزیه و تحلیل می کند.
تیمی به سرپرستی پروفسور خوزه مانوئل گارسیا آزنار، از موسسه تحقیقاتی مهندسی دانشگاه UZ در آراگون (I3A)، که در آن محققین یاگو جاست لاناس و کارلوس بوراو شرکت دارند، یک فناوری نوآورانه مبتنی بر دستگاه های میکروسیال با ماتریس های خارج سلولی کلاژن سه بعدی را به کار بردند. برجستگیهای سلول سرطانی و مهاجرت سلولی را در محیطهایی که مراحل مختلف رشد تومور را شبیهسازی میکنند، مطالعه کنید.
سلولهای مرتبط با سرطان مزیت مهاجرتی – حرکت سریعتر و جهتدارتر – را در محیطی معمولی از مراحل اولیه سرطان نشان دادند. همچنین، محققان در این سلولهای مرتبط با سرطان، ظرفیت تکثیر پایینتری را مشاهده کردند که شامل اثر افزایشی SMAD3 بهعنوان یک عامل ضروری برای بهکارگیری و تجمع CAFs در آدنوکارسینوما بود.
از آنجایی که این سلول های مرتبط با سرطان در تمام مراحل رشد تومور – از جمله انتشار – کمک می کنند، این یافته می تواند برای درک انتشار زودهنگام آدنوکارسینوم در سایر اندام ها تعیین کننده باشد. علاوه بر این، این مزیت مهاجرتی توسط مهارکننده Trametinib حذف شد، که قبلاً برای استفاده در انواع دیگر تومورها تأیید شده است.
به گفته لاناس، نویسنده اول این مطالعه، محققان دریافتند که سلولهای مرتبط با تومور آدنوکارسینوم ظرفیت مهاجرت بالایی دارند. در بیمارانی که علل آن هنوز ناشناخته است. علاوه بر این، طبق نتایج ما، مهارکنندههایی مانند Trametinib میتوانند در برابر جذب مؤثر باشند.»
در محیطهای نزدیک به تومور توسعهیافتهتر، محققان بیان کردهاند که سلولهای مرتبط با آدنوکارسینوما به دلیل کاهش ظرفیت مهاجرتی که در این مطالعه مشاهده میشود، میتوانند تعاملات نزدیکتری با سلولهای تومور برقرار کنند.
محققان خاطرنشان کردند: «ما به کار ادامه می دهیم تا بفهمیم آیا سلول های مرتبط با آدنوکارسینوم ریه می توانند با مکانیسم های دیگر گسترش این تومورها را نیز با هدف نهایی مهار متاستاز آنها افزایش دهند یا خیر».
اطلاعات بیشتر:
Yago Juste-Lanas و همکاران، الگوهای مهاجرت کلاژن سه بعدی یک مکانیسم وابسته به SMAD3 و مستقل از TGF-β1 را برای استخدام فیبروبلاست های مرتبط با تومور در آدنوکارسینوم ریه نشان می دهند. مجله سرطان بریتانیا (2022). DOI: 10.1038/s41416-022-02093-x
ارائه شده توسط دانشگاه بارسلونا
نقل قول: مکانیسم استخدام برای فیبروبلاستهای مرتبط با سرطان در سرطان ریه رایج کشف شد (2023، 31 ژانویه) در 31 ژانویه 2023 از https://medicalxpress.com/news/2023-01-mechanism-cancer-associated-fibroblasts-common-lung بازیابی شده است. html
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
[ad_2]