[ad_1]
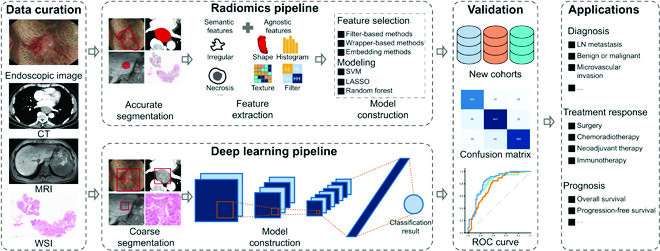
گردش کار تجزیه و تحلیل هوش مصنوعی در نئوپلاسم های دستگاه گوارش SVM، ماشین بردار پشتیبانی؛ LASSO، کمترین عملگر انقباض و انتخاب مطلق. LN، غدد لنفاوی؛ ROC، ویژگی عملکرد گیرنده؛ هوش مصنوعی، هوش مصنوعی اعتبار: Health Data Science
هوش مصنوعی به تشخیص زودهنگام و بهتر سرطانهای گوارشی کمک میکند، اما چالشهای زیادی برای کاربردهای بالینی گسترده، از جمله اشتراکگذاری محدود دادههای تصویربرداری پزشکی بین بیمارستانها، و عدم استانداردسازی پروتکلهای تصویربرداری پزشکی برای هوش مصنوعی باقی مانده است. پس از یک بررسی جامع از کاربردهای اخیر این فناوری در مرگبارترین سرطان ها به این نتیجه رسیده است.
مقاله ای که یافته های آنها را توصیف می کرد در مجله ظاهر شد علوم داده های بهداشتی.
تومورهای دستگاه گوارش با نرخ بقای پنج ساله زیر 20 درصد، علت اصلی مرگ و میر ناشی از سرطان در سراسر جهان هستند. پنج سرطان از هفت مرگبارترین سرطان محصول این تومورهای دستگاه گوارش یا نئوپلاسم ها هستند، همانطور که پزشکان تومورها را توصیف می کنند: سرطان مری، سرطان معده، سرطان کولورکتال، سرطان اولیه کبد و سرطان پانکراس.
درمان بالینی نئوپلاسم های دستگاه گوارش (DSNs) در دهه های اخیر بهبود یافته است، اما پیش آگهی بیماران DSN ناگوار باقی مانده است. این تا حدودی به دلیل ماهیت تهاجمی این سرطان ها است، اما احتمالاً به دلیل چالش هایی است که در دستیابی به تشخیص زودهنگام و پاسخ درمانی دقیق وجود دارد.
جی تیان، متخصص هوش مصنوعی در آزمایشگاه کلیدی پزشکی دقیق مبتنی بر دادههای بزرگ در دانشگاه بیهانگ و یکی از نویسندگان مقاله، میگوید: «اگر زودتر بتوان تشخیصهای برتر را انجام داد، باید پیشآگهیها را بهبود بخشد.
ارزیابیهای ژنومی و پروتئومی تومورهای مبتنی بر بافت، نویدهای بسیار زیادی را در زمینه تشخیصی ارائه میدهند. این فناوریهای جدید میتوانند کل ژنوم و مجموعه کامل پروتئینهای تولید شده توسط سلولها را در نمونه بافتی از یک تومور توالیبندی کنند. اما همچنین ذاتاً با این واقعیت محدود می شوند که بخش کوچکی از بافت تومور هرگز نمی تواند کل تومور را نشان دهد.
تصویربرداری پزشکی مانند توموگرافی کامپیوتری (CT)، تصویربرداری رزونانس مغناطیسی (MRI) و توموگرافی انتشار پوزیترون (PET) در اصل میتواند یک توصیف مکمل اما جامعتر تومور را ارائه دهد. این تکنیک های تصویربرداری پزشکی به طور منظم به عنوان بخشی از روال بالینی برای تشخیص قبل از عمل و ارزیابی پاسخ درمانی استفاده می شود.
اما ارزیابی ویژگیهای بالینی یک تومور که به تشخیص کمک میکند، به همان اندازه یک هنر کیفی است که یک علم کمی است، با تنوع زیادی بین رادیولوژیستهای مختلف که تصویربرداری را انجام میدهند. چنین ارزیابی از تصاویر پزشکی نیز بسیار وقت گیر و کار فشرده است.
با این حال، الگوریتمهای هوش مصنوعی (AI) میتوانند ویژگیهای تصویربرداری خاصی را از تصاویر پزشکی بهطور خودکار استخراج کنند، که میتواند فرآیند پیچیده را نه بهجای آن، بلکه به عنوان کمکی به پزشکان، خودکار کند و حجم کاری آنها را کاهش دهد.
حتی بهتر از آن، همانطور که در بسیاری از زمینههای فراتر از پزشکی نشان داده شده است، یک هوش مصنوعی میتواند ویژگیها و الگوهای تصویربرداری را استخراج کند که با چشم غیرمسلح یا اصلاً توسط انسان قابل تشخیص نیستند.
و بنابراین علاوه بر این فناوریهای جدید شگفتانگیز توالییابی ژنومی و پروتئومی و تصویربرداری پزشکی متعارف، در دهه گذشته، تحقیقات و آزمایشهای زیادی در مورد اینکه آیا هوش مصنوعی میتواند نه تنها با هدف تشخیصهای قبلی کمک کند، صورت گرفته است. پروفسور تیان ادامه داد، “اما برای ایجاد تشخیصهایی که بسیار بیشتر برای بیمار، برای کل تومور او – چیزی که ما آن را پزشکی دقیق مینامیم، مطابقت دارد.”
این گروه میخواست وضعیت تحقیقات در مورد استفاده از سیستمهای هوش مصنوعی برای کمک به تشخیص DSN و اینکه چگونه تلاشهای تجربی تاکنون در چهار سرطان رایج دستگاه گوارش مؤثر بوده است را بررسی کنند. مقاله آنها نمای کلی از میزان پیشرفت چنین تحقیقاتی را ارائه می دهد و چالش هایی را که هنوز باید بر آنها غلبه کرد را بیان می کند.
آنها اشاره می کنند که دو رویکرد اصلی هوش مصنوعی برای تصویربرداری پزشکی DSN وجود دارد: رادیومیک و یادگیری عمیق. اولین مورد شامل یک هوش مصنوعی است که از الگوریتم های مشخصه داده برای استخراج ویژگی های تصویربرداری از تصویر استفاده می کند. این شامل تقسیمبندی یک تصویر، یا «تکهکردن» جزئیات بخشهای مختلف تصویر به بخشهای مختلف است. کدام پیکسل در یک تصویر بخشی از تومور است و کدام یک چیز دیگر؟ با رادیومیک، رادیولوژیست ها اغلب به صورت دستی قسمت های مختلف را برچسب گذاری می کنند تا هوش مصنوعی را برای درک و طبقه بندی این بخش ها آموزش دهند.
Shuaitong Zhang، نویسنده دیگر مقاله و دانشیار دانشگاه Beihang گفت: «این تقسیمبندی دستی بار دیگر کار فشرده است، بنابراین به سختی حجم کار را در مقایسه با ارزیابی انسانی از یک تصویر پزشکی کاهش میدهد.
و همچنین یک بار دیگر تنوع را از رادیولوژیست به رادیولوژیست معرفی می کند.”
با این حال، با یادگیری عمیق، شکل پیچیدهتری از هوش مصنوعی، این سیستم تنها به یک بخشبندی بسیار درشت از مناطق تومور قبل از خودآموزی نیاز دارد و به طور خودکار برچسبهای بخش خود را ارائه میکند.
هم رادیومیک و هم یادگیری عمیق عمیقاً به مجموعه دادههای بزرگ و مشروحشده از بیمارستانهای زیادی بستگی دارد تا یک مدل داخلی قوی از تومورها ساخته شود که میتوان آن را به هر بیمار تعمیم داد.
اینجاست که اولین چالش بزرگ ظاهر می شود. شیوه های بدست آوردن و پارامترسازی چنین تصاویر پزشکی به طور قابل ملاحظه ای بین بیمارستان های مختلف متفاوت است و بر استحکام و در نتیجه تعمیم هر مدل هوش مصنوعی تأثیر می گذارد. علاوه بر این، تعداد زیادی تصویر پزشکی از DSN ها وجود دارد، داده های تصویری با حاشیه نویسی مناسب محدود هستند.
با این حال محققان نتیجه می گیرند که روش های متعددی وجود دارد که می تواند این مشکل را کاهش دهد، از جمله نمونه برداری مجدد از تصویر. چرخش، چرخاندن و جابجایی تصاویر؛ و محو کردن دقیق تصاویر برای کاهش نویز تصویر. علاوه بر این، استانداردسازی پروتکلهای تصویربرداری پزشکی برای هوش مصنوعی باید بتواند تکرارپذیری و مقایسه را بهبود بخشد.
علاوه بر این، مجموعه دادههای با کیفیت بالا معمولاً در دسترس عموم نیستند، که میتواند اعتبارسنجی و مقایسه مدلهای مختلف هوش مصنوعی را مختل کند.
دکتر ژانگ گفت: «اشتراکگذاری سخاوتمندانهتر دادهها برای یک مدل هوش مصنوعی قوی و قابل اجرا بالینی حیاتی خواهد بود.
در حال حاضر، اکثر مطالعات منتشر شده در مورد استفاده از هوش مصنوعی برای ارزیابی DSN در حوزه کار فشردهتر و زمانبر تمرین رادیومیک و یادگیری عمیق باقی ماندهاند. اشتباه فعلی یادگیری عمیق احتمالاً به دلیل پیچیدگی زیاد تومورها است.
هر دو شکل کمک تشخیصی هوش مصنوعی در واقع مزایای قابل توجهی را در چهار سرطان در نظر گرفته نشان میدهند، و عملکرد بهتری نسبت به ارزیابی انسانی از تصویربرداری پزشکی به تنهایی دارند و به عنوان مثال شناسایی بهتر بیماران پرخطری را که نیاز به درمان فشرده دارند، ممکن میسازند. اما شدت کار رادیومیک ها ممکن است مانع از کاربرد گسترده آن شود.
چالش نهایی مربوط به نیاز پزشکان است تا بتوانند آنچه را که مدل داخلی هوش مصنوعی بیان میکند تفسیر کنند. این به ویژه برای مدلهای یادگیری عمیق صادق است، جایی که آنچه توسط هوش مصنوعی شناسایی میشود و چرا چیزی شبیه به یک «جعبه سیاه» باقی میماند. و بنابراین، قبل از کاربرد در عمل بالینی، محققان توصیه میکنند که تشخیص DSN به کمک هوش مصنوعی در کارآزماییهایی با تعداد شرکتکنندگان بسیار بیشتر در بسیاری از بیمارستانها نسبت به کارآزماییهای عمدتا کوچکی که محققان برای مقاله نظرسنجی خود در نظر گرفتهاند، تایید شود.
به نوبه خود، تیم اکنون قصد دارد مدل هوش مصنوعی خود را توسعه دهد که به سرطان مری اختصاص دارد، اما مدلی که به سادگی توسط پزشکان قابل تفسیر باشد.
اطلاعات بیشتر:
Shuaitong Zhang و همکاران، کاربردهای هوش مصنوعی در نئوپلاسم های دستگاه گوارش: بررسی، علوم داده های بهداشتی (2022). DOI: 10.34133/hds.0005
ارائه شده توسط Health Data Science
نقل قول: هوش مصنوعی تشخیص سرطان گوارش را بهبود میبخشد، اما موانع اشتراکگذاری دادهها باقی میماند (2023، 2 مارس) در 2 مارس 2023 از https://medicalxpress.com/news/2023-03-ai-digestive-cancer-diagnosis-data-sharing بازیابی شده است. html
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
[ad_2]