[ad_1]
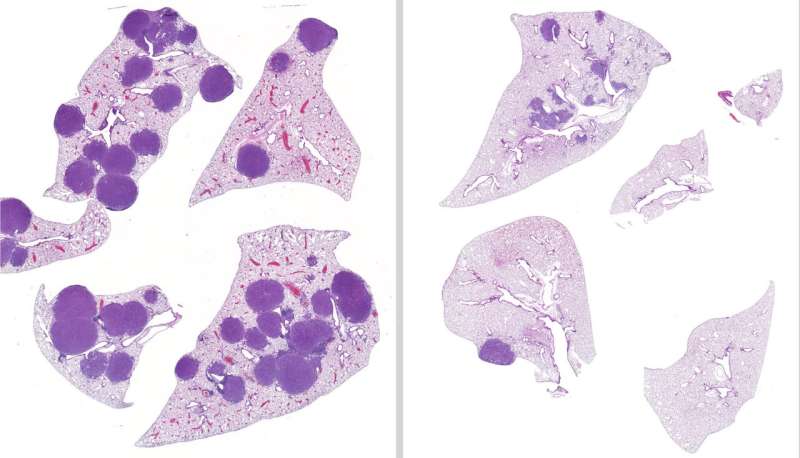
سمت چپ: بافت ریه موش های مبتلا به سرطان ریه سلول غیرکوچک جهش یافته با LKB1. سمت راست: بافت ریه پس از درمان با ترامتینیب و انتیوستات که تومورهای کوچکتر و کمتری را نشان می دهد. اعتبار: موسسه سالک
درمانهای سرطان مدتهاست که به سمت شخصیسازی حرکت میکنند – یافتن داروهای مناسبی که برای تومور منحصر به فرد بیمار، بر اساس الگوهای ژنتیکی و مولکولی خاص کار میکنند. بسیاری از این درمانهای هدفمند بسیار مؤثر هستند، اما برای همه سرطانها، از جمله سرطانهای سلول غیرکوچک ریه (NSCLCs) که دارای جهش ژنتیکی LKB1 هستند، در دسترس نیستند.
یک مطالعه جدید به رهبری پروفسور روبن شاو موسسه سالک و لیلیان آیچنر، همکار سابق فوق دکترا، که اکنون استادیار دانشگاه نورث وسترن است، نشان داد که ترامتینیب و انتینوستات مورد تایید FDA (که در حال حاضر در آزمایشات بالینی قرار دارد) می توانند به صورت پشت سر هم برای تولید کمتر و کوچکتر تجویز شوند. تومورها در موش های مبتلا به NSCLC جهش یافته با LKB1
یافته ها در منتشر شد پیشرفت علم در 17 مارس 2023.
شاو، نویسنده ارشد و همکار این مطالعه و مدیر مرکز سرطان سالک میگوید: برای موارد سرطان ریه سلولی غیرکوچک با جهش LKB1، درمانهای استاندارد شیمیدرمانی و ایمونوتراپی مؤثر نیستند. یافتههای ما نشان میدهد راهی برای هدف قرار دادن این موارد با استفاده از داروهایی وجود دارد که مورد تایید FDA هستند یا در حال حاضر در آزمایشهای بالینی هستند، بنابراین این کار میتواند به راحتی برای یک کارآزمایی بالینی در انسان مورد استفاده قرار گیرد.
تقریباً 20 درصد از همه NSCLC ها دارای جهش ژنتیکی LKB1 هستند، به این معنی که در حال حاضر هیچ درمان هدفمند موثری برای بیماران مبتلا به این نوع سرطان در بازار وجود ندارد. برای ایجاد درمانی که بتواند جهش LKB1 را هدف قرار دهد، محققان به هیستون داستیلازها (HDACs) روی آوردند. HDAC ها پروتئین هایی هستند که با رشد تومور و متاستاز سرطان همراه هستند، با بیان بیش از حد مشخصه در تومورهای جامد.
چندین داروی بازدارنده HDAC قبلاً مورد تأیید FDA (ایمن برای استفاده انسانی) برای اشکال خاص لنفوم هستند، اما اطلاعاتی در مورد اثربخشی آنها در تومورهای جامد یا اینکه آیا تومورهایی که دارای تغییرات ژنتیکی خاص هستند ممکن است پتانسیل درمانی بالایی را نشان دهند، وجود ندارد.
بر اساس یافتههای قبلی که ژن LKB1 را به سه HDAC دیگر متصل میکند که همگی به HDAC3 متکی هستند، تیم با انجام یک تجزیه و تحلیل ژنتیکی HDAC3 در مدلهای موشی NSCLC شروع کرد و یک نقش غیرمنتظره حیاتی برای HDAC3 در چندین مدل را کشف کرد. پس از اینکه مشخص شد HDAC3 برای رشد تومورهای جهش یافته LKB1 که درمان آن دشوار است، حیاتی است، محققان سپس بررسی کردند که آیا مسدود کردن HDAC3 از نظر دارویی میتواند اثر مشابهی داشته باشد یا خیر.
تیم در مورد آزمایش دو دارو کنجکاو بود، انتیوستات (یک مهارکننده HDAC در آزمایشهای بالینی که HDAC1 و HDAC3 را هدف قرار میدهد) و ترامتینیب مورد تایید FDA (یک مهارکننده برای کلاس متفاوتی از آنزیمهای مرتبط با سرطان). تومورها اغلب به سرعت به ترامتینیب مقاوم می شوند، اما درمان همزمان با دارویی که پروتئین پایین دست HDAC3 را مهار می کند به کاهش این مقاومت کمک می کند.
از آنجایی که این پروتئین به HDAC3 متکی است، محققان بر این باور بودند که دارویی که HDAC3 را مورد هدف قرار می دهد – مانند انتیوستات – به مدیریت مقاومت به ترامتینیب نیز کمک می کند.
پس از درمان موشهای مبتلا به سرطان ریه جهشیافته با LKB1 با رژیمهای درمانی متغیر به مدت 42 روز، این تیم متوجه شد که موشهایی که هم انتیوستات و هم ترامتینیب داده بودند، 79 درصد حجم تومور کمتر و 63 درصد تومور کمتری در ریههایشان نسبت به موشهای درماننشده داشتند. علاوه بر این، تیم تایید کرد که انتیوستات یک گزینه درمانی مناسب در مواردی است که تومور به ترامتینیب مقاوم است.
Eichner، نویسنده اول و همکار، می گوید: “ما فکر می کردیم کل کلاس آنزیم HDAC مستقیماً با علت سرطان ریه جهش یافته LKB1 مرتبط است. اما نقش خاص HDAC3 در رشد تومور ریه را نمی دانستیم.” ما اکنون نشان دادهایم که HDAC3 در سرطان ریه ضروری است و این یک آسیبپذیری قابل درمان در مقاومت درمانی است.
این یافتهها ممکن است منجر به آزمایشهای بالینی برای آزمایش رژیم جدید در انسان شود، زیرا انتیوستات در حال حاضر در آزمایشهای بالینی است و ترامتینیب مورد تایید FDA است. نکته مهم، شاو این کشف را برای سرطانهای فراتر از NSCLC، با کاربردهای بالقوه در لنفوم، ملانوم و سرطان پانکراس، تحولبخش میداند.
شاو، دارنده صندلی ویلیام آر برودی، میگوید: «آزمایشگاه ما سالها متعهد به این پروژه بوده و گامهای کوچک و معنیداری در جهت این یافتهها برداشته است. “این واقعاً یک داستان موفقیت آمیز است برای اینکه چگونه علم اکتشافات اساسی می تواند به راه حل های درمانی در آینده نه چندان دور منجر شود.”
“آزمایشگاه مستقل من خوش شانس است که بخشی از مرکز سرطان لوری در دانشکده پزشکی فاینبرگ در دانشگاه نورث وسترن است، که بسیار از تحقیقات ترجمه حمایت می کند. ما امیدواریم که این محیط شروع یک کارآزمایی بالینی را بر اساس این یافته ها تسهیل کند. آیچنر می گوید.
اطلاعات بیشتر:
Lillian Eichner و همکاران، HDAC3 در توسعه تومور و مقاومت درمانی در سرطان ریه سلول غیر کوچک کراس-جهش حیاتی است. پیشرفت علم (2023). DOI: 10.1126/sciadv.add3243. www.science.org/doi/10.1126/sciadv.add3243
ارائه شده توسط موسسه سالک
نقل قول: ترکیب جدیدی از داروها برای کاهش تومورهای ریه در موش ها با هم کار می کند (2023، 17 مارس) در 17 مارس 2023 از https://medicalxpress.com/news/2023-03-combination-drugs-lung-tumors-mice.html بازیابی شده است.
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
[ad_2]