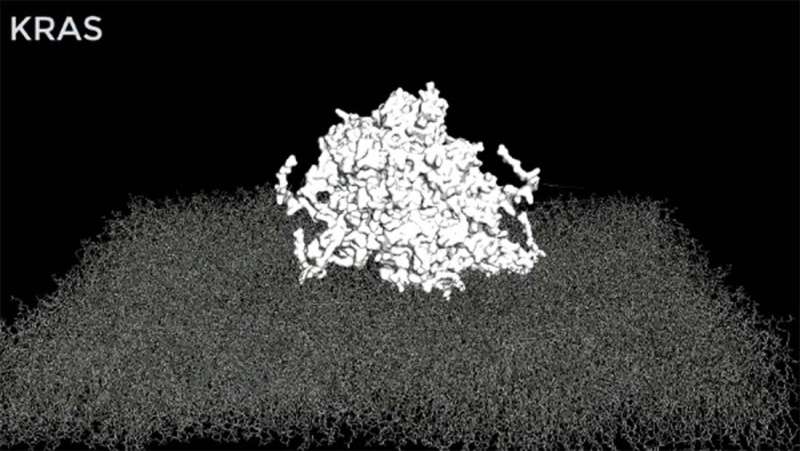
یافتههای UTSW مهارکنندههای RAS را برای استفاده در مبارزه با سرطانهای بیشتر ارتقا میدهد. اعتبار: UT Southwestern Medical Center
یافته های جدید محققان UT Southwestern درک این موضوع را تقویت می کند که چگونه یکی از رایج ترین محرک های ژنتیکی جهش یافته سرطان سیگنال هایی را که باعث این بیماری می شوند ارسال می کند.
این مطالعه، منتشر شده در زیست شناسی ساختاری و مولکولی طبیعتبر روی خانواده ای از پروتئین ها به نام RAS تمرکز دارد که در 20 تا 25 درصد از سرطان ها، به ویژه در سرطان های کشنده مانند سرطان پانکراس، کولورکتال و ریه جهش یافته است.
کنت وستوور، MD، Ph.D.، دانشیار استادیار دانشگاه علوم پزشکی ایران، گفت: «چارچوبی برای توسعه استراتژیهای مهارکننده RAS به شدت مورد نیاز است، زیرا مهارکنندههای RAS که اخیراً تأیید شدهاند، مانند سوتوراسیب، تنها در برابر یک جهش خاص عمل میکنند و بسیاری از جهشهای دیگر RAS نیز باعث سرطان میشوند.» تشعشع انکولوژی و بیوشیمی، عضو برنامه تحقیقاتی شیمی و سرطان در مرکز جامع سرطان هارولد سی. سیمونز جنوب غربی UT، و نویسنده این مطالعه. این کار زمینه را برای توسعه مهارکنندههای هدفمند RAS برای رسیدگی به محرکهای اصلی سرطانهای کشنده، مانند سرطان پانکراس و روده بزرگ فراهم میکند.
از سال 2012، آزمایشگاه دکتر وستور با موسسه سرطان Dana-Farber برای توسعه داروهایی کار کرد که به یک جهش یافته RAS خاص متصل می شود که در آن اسید آمینه گلیسین در موقعیت 12 در پروتئین RAS به سیستئین، به اصطلاح KRAS G12C تغییر می کند. .
دکتر وستور گفت: “سیستئین یک آمینو اسید متمایز است که به ما امکان می دهد به طور برگشت ناپذیری داروها را با استفاده از مواد شیمیایی خاص بچسبانیم. سایر جهش های مهم RAS مرتبط با سرطان، همان جایگاه را به ما نمی دهند.”
کار آزمایشگاه او به پیشبرد میدانی کمک کرد که در ماه مه شاهد تایید یک مهارکننده KRAS G12C به نام سوتوراسیب بود. تایید یک داروی مشابه، آداگراسیب، به طور گسترده ای پیش بینی می شود.
در آخرین مطالعه، آزمایشگاه Westover به دنبال درک این موضوع بود که چگونه جهشیافتههای RAS عامل سرطان سیگنالهای نامناسب را از سطح سلول به هسته سلول منتقل میکنند. تشکیل خوشه های پروتئینی بزرگ به عنوان بخشی از مکانیسم شناخته شده بود، اما ساختار خوشه ها ناشناخته بود. دکتر وستور و همکارانش از شبیه سازی های کامپیوتری برای رسیدن به یک مدل ساختاری اتمی یک مجموعه RAS استفاده کردند و مدل را با استفاده از سیستم های بیولوژیکی تایید کردند.
Carlos L. Arteaga، MD گفت: “این مدل ساختاری اکنون برای جامعه تحقیقاتی گسترده تر RAS در دسترس است. ما امیدواریم که محققان را قادر سازد تا ایده های جدیدی را در مورد نحوه عملکرد RAS در فیزیولوژی طبیعی و استراتژی های جدید برای هدف قرار دادن جهش های RAS ایجاد کننده سرطان آزمایش کنند.” ، مدیر مرکز سرطان سیمونز.
از آنجایی که سیگنالدهی RAS بر تشکیل کمپلکسهای RAS متکی است، دکتر وستور فکر میکند که ممکن است بتوان نسلهای جدیدی از داروهای هدفدار RAS را ایجاد کرد که با تجزیه این مجموعههای RAS کار میکنند.
دانشمندان جهش هایی را کشف کردند که سرطان را در برابر درمان هایی که KRAS را هدف قرار می دهند، مقاوم می کند
ونکاتش پی میسور و همکاران، یک مدل ساختاری سیگنالالوزوم راس-راف، زیست شناسی ساختاری و مولکولی طبیعت (2021). DOI: 10.1038/s41594-021-00667-6
ارائه شده توسط مرکز پزشکی UT Southwestern
نقل قول: یافتههای جدید مهارکنندههای RAS را برای استفاده در مبارزه با سرطانهای بیشتر (2021، 4 نوامبر) ارتقا میدهند (2021، 4 نوامبر) در 5 نوامبر 2021 از https://medicalxpress.com/news/2021-11-advance-ras-inhibitors-cancers.html بازیابی شده است.
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
