[ad_1]
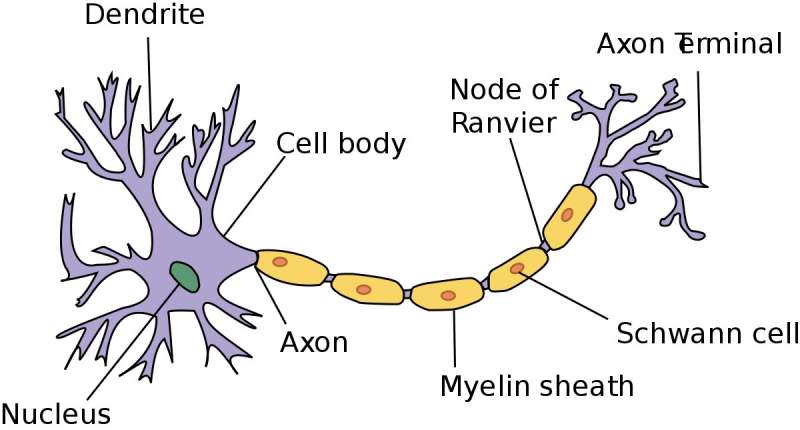
اعتبار: ویکی پدیا
به دانشجویان فیزیولوژی همواره آموزش داده می شود که وظیفه اصلی میلین عایق بندی اعصاب است. به ویژه، با افزایش ضخامت غشا و در نتیجه کاهش ظرفیت الکتریکی آن، پتانسیل های عمل را کارآمدتر می کند. اما این ایده خام – واقعاً این قیاس – نمی تواند درست باشد. علیرغم اعتراض دانشمندان علوم اعصاب جزمی، نورونها وسایل الکتریکی نیستند، حداقل به معنای جریان الکترونها در سیمها.
مطمئناً، به نظر میرسد که جریانهای الکترونی زیادی در غشای داخلی میتوکندریها در اعماق نورونها از میان و بین پروتئینها جریان مییابد (برخی میگویند تا ۵۰ آمپر برای کل بدن)، اما این جریانها هیچ ارتباطی با انتشار پتانسیل عمل ندارند. سنبله ها اختلالات بیوفیزیکی چندوجهی در آکسون ها هستند. آنها به وضوح دارای یک جزء یونی به شکل جریان های مختلف سدیم، پتاسیم، کلرید، کلسیم، و احتمالاً حتی پروتون ها از طریق کانال ها و پمپ ها هستند. با این حال، الکترون ها حامل هیچ جریان یا رسانایی در اینجا نیستند.
بنابراین، میلین در واقع برای آکسون چه می کند؟ یکی از پاسخهای رایج این بوده است که نوعی حمایت انرژیزا یا تغذیهای را فراهم میکند، شاید بسیار شبیه نوعی میتوکندری که میتواند ATP را از طریق فسفوریلاسیون اکسیداتیو از طریق کمپلکسهای تنفسی بیان شده خارج از رحم تولید کند. ادبیات جالبی وجود دارد که حضور کمپلکس تنفسی احتمالاً کارآمد V، F را توصیف می کند.1افO-ATP سنتاز، خارج از میتوکندری در مکان هایی مانند بخش های بیرونی میله در شبکیه و در سلول های میلین کننده. با توجه به وجود چندین نوع ATP-ase که در بخشهای مختلف سلولی یافت میشوند، این ممکن است چندان شگفتانگیز نباشد.
به نظر می رسد که به دلیل نیاز به ساخت و ساز داخلی، و درج غشای متعاقب پروتئین های بیان شده میتوکندری بسیار آبگریز، و پردازش و بلوغ گسترده درون میتوکندریایی، برای سلول ها کاملا غیرممکن است که مجتمع های تنفسی کامل را خارج از میتوکندری جمع کنند. زیرواحدهای پروتئین مشتق شده از هسته (به عنوان مثال، این نقد بیان آلتوپی پروتئین های میتوکندری را ببینید). با این وجود، راههای دیگری وجود دارد که این پروتئینها ممکن است پس از جمعآوری به غشای پلاسمایی راه پیدا کنند. تخریب خلاقانه بخشهایی از میتوکندری، با تشکیل انواع وزیکولهای جوانهدار تک و دو پوسته، میتواند مجتمعها را به مرزها و فراتر از آن منتقل کند.
در شماره جاری انجمن سلطنتی زیست شناسی باز، الساندرو مورلی و همکاران. شواهد جالبی ارائه میکند که غلافهای میلین با ساختارهای چندلایهای متحدالمرکز دارای انرژی زیستی مشابه با تیلاکوئیدهای سیانوباکتری هستند. علاوه بر انبوهی از اصلاحات مولکولی التقاطی که مشترک هستند، هر دو ساختار عملکرد ظاهری تغذیه مواد مغذی، به طور بالقوه از جمله ATP مشتق شده از ATP-سینتاز، را در قلب مرکزی یک ساختار پیچیده چند لایه ای به اشتراک می گذارند. هیچ کس ادعا نمی کند که میلین خود از غشای تیلاکوئیدها مشتق شده است، زیرا این امر از نظر طبقه بندی غیرممکن به نظر می رسد، فقط این مشاهدات ممکن است نمونه ای روشنگر از تکامل همگرا برای انجام برخی وظایف اساساً مشابه باشد.
فراتر از ساختار ناخالص و تولید ATP، سرنخ های دیگری نیز برای این تابع اساسی مشترک وجود دارد. به عنوان مثال، لیپیدهای متحدالمرکز محکم بسته بندی شده به طور قابل اعتماد به عنوان ساختار بهینه طبیعت برای حل و جداسازی بیشترین مقدار گاز در یک حجم خاص ظاهر می شوند. لیپیدها، به ویژه لیپیدهای خنثی، می توانند حدود پنج برابر بیشتر از آب گاز در خود نگه دارند. در این مورد، سیانوباکتری ها بیشترین علاقه را به حل CO دارند2 برای ساخت کربوهیدرات، و نیتوژن برای تثبیت، در حالی که میلین بدون شک به دنبال O2. بافتهای مغزی (مانند سایر بافتهای با تنفس بالا مانند ماهیچهها) از داشتن یک میوگلوبین با میل ترکیبی بالا برای ربودن O را ندارند.2 از هموگلوبین در گردش
ممکن است جالب باشد که مقاطع تاجی مغز سیتاس را با مغز انسان با توجه به قشر بسیار نازک تر و پیچیده تر سیتوس مقایسه کنیم که تحت فشار انتخابی شرایط محروم از اکسیژن تکامل یافته است. قشر سیتوس احتمالاً دارای غلبه زیادی از نورون های برجسته لایه عمیق نسبت به لایه های فوقانی نازک آنها به منظور به حداکثر رساندن تعداد آکسون های موجود برای تولید ماده سفید است. نگاهی گذرا به مغز دلفینها در تصاویر گوگل این را پشتیبانی نمیکند. با این حال، یک حسابداری جامع تر می تواند روشنگر باشد. عجیب است که ساختارهای چند لایه متحدالمرکز نیز در سورفکتانت ریه، عنصر حیاتی برای O خوب تولید می شوند.2 جذب توسط آلوئول های ریوی بیرونی ترین لایه سلول های اپیتلیال ریوی نیز دارای ساختارهای لایه ای مشابه است.
برای غلبه بر نیروهای دافعه با بار منفی فسفولیپیدها در ساختارهای چندلایه ای، به نظر می رسد طبیعت به اتفاق آرا با کهکشانولیپیدها رفته است. این لیپیدها، که گالاکتوز را به عنوان گروه قند خود دارند، در میان لیپیدهای غشای گیاهی مورد علاقه هستند، جایی که احتمالاً برای حفظ فسفات برای سایر فرآیندهای ضروری، جایگزین فسفولیپیدها می شوند. گالاکتولیپیدها حدود 70 درصد لیپیدهای سیانوباکتری تیلاکوئیدها، تا 80 درصد در تیلاکوئیدهای گیاهی و حدود 30 درصد در میلین را تشکیل می دهند. همچنین نشان داده شده است که گالاکتولیپیدهای میلین برای تشکیل مناسب گره های Ranvier ضروری هستند.
مشترک دیگر با تیلاکوئیدها، همسانی نزدیک در توالی پروتئین کانال های یونی غیرانتخابی در تیلاکوئیدها با کانال های آنیونی وابسته به ولتاژ (VDAC) است که به وفور در میتوکندری ها و دیگر ساختارهای غشایی بیان می شود. در میلین، VDAC به طور بالقوه می تواند به کمپلکس هایی تبدیل شود که یک منفذ مرکزی با قطر تقریباً 1.3 نانومتر، تقریباً به اندازه منافذ کانال یونی تیلاکوئید تشکیل می دهند. در جلبک تک سلولی سبز Chlamydomonas reinhardtii، این کانال ها پشته های تیلاکوئید را به یک ساختار اساسی به نام پیرنوئید متصل می کنند. بی کربنات، NADPH و ATP همگی از طریق منافذ به پیرنوئید مرکزی هدایت می شوند تا چرخه کالوین-بنسون را تغذیه کنند.
غلظت بسیار بالایی از آنزیم RuBisCo برای CO مورد نیاز است2 ادغام در ترکیبات آلی در حالی که RuBisCo فراوان ترین پروتئین در کل بیوسفر ما است، تنها بازده کاتالیزوری متوسطی را نشان می دهد. این دلیل محتمل است که هسته های متراکم کمپلکس های RuBusCo که کربوکسیزوم را تشکیل می دهند در اعماق مراکز ساختارهای لایه ای متحدالمرکز یافت می شوند. برای حمل CO2 تا پایان تجاری تیلاکوئیدها، کربنیک انیدراز برای تشکیل یک بی کربنات واسطه مورد نیاز است، همان طور که در ما وجود دارد. کربنیک انیدراز در میتوکندری برای تبدیل CO مشتق شده از چرخه کربس ضروری است2 به بی کربنات تبدیل شود. محل دیگری که کربنیک انیدراز در آن یافت می شود غلاف میلین است که نشان دهنده نقش متابولیکی در مدیریت این گونه گازی است.
میتوکندری ها حاوی بخش های غشایی گسترده ای هستند که به عنوان کریستا شناخته می شوند. معمولاً این عناصر پشته های موازی را تشکیل می دهند که به طور پراکنده به وسیله اتصالات کریستای لوله ای به غشای خارجی متصل می شوند. تحت شرایط خاص، این کریستاها می توانند به طور کامل خود را به غشاهای متحدالمرکز و پیاز مانند پیکربندی کنند. بسیاری از دستکاریها، چه طبیعی و چه مصنوعی، باعث میشوند که میتوکندریها کریستای متحدالمرکز را بپذیرند، از جمله تغییرات در بیان ATP-سینتاز. مدتی پیش، چند محقق پیشنهاد کردند که میلین مانند یک میتوکندری عمل می کند. یک اعتراض نظری به این مفهوم بعداً ادعا کرد که اگر یک ATP-ase اشتباه ممکن است در میلین پیدا کند، در بهترین حالت، فقط میتواند برعکس عمل کند تا ATP را تجزیه کند.
این محاسبات نویسنده برای نیروی محرکه پروتون در سراسر غشای میلین بر اساس مقادیر شناخته شده pH و پتانسیل غشایی الیگودندروسیت، و چند فرض در مورد پیکربندی و قطبیت اساسی ATPsynthase در غشاء بود. اثبات نظری این یا آن متابولیک، مانند مقدار انرژی مورد نیاز نورونها، بسیار دشوار است – طبیعت همیشه از این که چقدر میتواند با این مقدار کم انجام دهد شگفتزده میکند. به عنوان مثال، همان محققانی که بر فرضیه میلین سایه انداختهاند، تلاشهای نجیبانهای برای محاسبه انرژی مورد نیاز برای آکسونهای پراکنده انجام دادهاند. در حالی که بسیاری از منابع انرژی مخفیانه نیز در دسترس آکسون هستند، مانند ژنراتورهای ATP متصل به وزیکول به شکل GADPH، آکسونها بسیار بیشتر از سنبله عمل میکنند. در واقع، اسپک زدن ممکن است در مقایسه با فرآیندهای فیزیکی بیشتر مانند حمل و نقل و رشد نسبتاً آسان باشد.
پیتر میچل، از شهرت نوبل، مفهوم نیروی محرکه H+ (معمولاً حدود 250 میلی ولت) را معرفی کرد که توسط اختلاف پتانسیل الکتریکی غشایی (Δψ) به اضافه اختلاف pH بین دو فاز آبی (ΔpH) تشکیل میشود. با این حال، در صحبت با الساندرو، یک پیشگام موجود که به طور ملموسی به آن دوران پرفیض متصل است، و هنوز کاملاً فعال است، به سرعت آشکار میشود که ممکن است همه چیز در سرزمین شیمیاسموتیک خوب نباشد. مشاهده شده است که سطح غشای بیولوژیکی از فاز آبی توده ای توسط مولکول های آب مرتب شده جدا می شود که یک مانع الکترواستاتیک را نشان می دهد، که برای H + حدود 120 مگا ولت است. بنابراین هر گونه محاسبه مقدار pmf در سطوح مختلف زمانی که زیست شناسی واقعی در نظر گرفته می شود چندان ساده نیست.

دکتر الساندرو مورلی
ماهیت پروتون های آزاد در داخل و اطراف غشاها نیز به همین ترتیب دشوار است. غلظت پروتون بالا احتمالاً برای غشاها چندان سالم نخواهد بود. با تکنیک های بهتر، متغیرهای فیزیکی در ساختارهایی مانند میتوکندری اکنون می توانند با دقت مکانی و زمانی بیشتر، اغلب با نتایج شگفت انگیز، اندازه گیری شوند. دماهای اعماق ماتریکس به معنای واقعی کلمه شعله ور می شوند، کلسیم جرقه های آتش می زند و پتانسیل های غشای میتوکندری تقریباً به اندازه سرعت سنبله های خود آکسون مادر کاهش می یابد.
نقش غیرمنتظره دو پروتئین میتوکندری متصل شونده به لیپید مرتبط با بیماری قلبی و دیابت
الساندرو ماریا مورلی و همکاران، غلاف میلین و تیلاکوئیدهای سیانوباکتری به عنوان ساختارهای چند لایه متحدالمرکز با خواص بیوانرژیک مشابه، زیست شناسی باز (2021). DOI: 10.1098/rsob.210177
© 2022 Science X Network
نقل قول: میلین در واقع چه می کند؟ (2022، 17 ژانویه) در 17 ژانویه 2022 از https://medicalxpress.com/news/2022-01-myelin.html بازیابی شده است.
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
[ad_2]