[ad_1]

آن رابینسون، رئیس بخش مهندسی شیمی کارنگی ملون، در آزمایشگاه خود تحقیقاتی را انجام می دهد. اعتبار: مهندسی شیمی کارنگی ملون
در آخرین مقاله تحقیقاتی خود، منتشر شده در مجله علوم اعصاب مولکولیآن رابینسون، رئیس دپارتمان مهندسی شیمی کارنگی ملون، توضیح میدهد که چرا درک پیشرفت تخریب عصبی در بیماری آلزایمر و درمان نهایی آن بسیار پیچیدهتر از آن چیزی است که محققان قبلاً تصور میکردند.
از هر ده آمریکایی بالای 65 سال، یک نفر از آلزایمر رنج میبرد و در افراد بالای 80 سال به یک سوم میرسد. این ششمین علت مرگ و میر در ایالات متحده است و بیش از پنج میلیون نفر در حال حاضر با این بیماری زندگی میکنند. در سراسر جهان، این تعداد به نزدیک به 50 میلیون نفر می رسد. سن مهمترین عامل در بروز علائم آلزایمر در فرد است و اگرچه اطلاعات تشخیصی برای تایید بیماری در حال بهبود است، اما هنوز هیچ درمان یا درمانی برای کاهش یا توقف پیشرفت بیماری وجود ندارد.
در تمام بیماری های عصبی، دژنراسیون از یک قسمت از مغز شروع می شود و به نواحی دیگر منتقل می شود و باعث آسیب گسترده و از بین رفتن بافت مغز می شود. در آلزایمر، چندین چیز، مانند وجود پپتید A-بتا یا یک آسیب، میتواند باعث شود تاو (پروتئینی در نورونها که مسئول تثبیت آن نورونها است) شروع به شکلدهی به روشهای ناکارآمد کند. اولین مورد در مجموعه ای از رویدادها با این حال، دانشمندان هنوز مطمئن نیستند که چگونه این تاو بیماری زا از سلولی به سلول دیگر منتقل می شود، بنابراین در سراسر مغز پخش می شود و ویران می کند. درک چگونگی مهار این بیماری در ناحیه کوچکی از مغز می تواند به کند کردن پیشرفت آن و توقف انحطاط شناختی مرتبط با آلزایمر کمک کند.
رابینسون میگوید: «تعدادی از مدلهای آلزایمر وجود داشتهاند که سعی میکنند توضیح دهند که چگونه تاو بد شکل از یک قسمت مغز به قسمت دیگر منتقل میشود. بسیاری از این مدلها از نقطه نظر همه یا هیچ به مشکل برخورد میکنند—پروتئین تاو معمولی فقط به این سمت میرود؛ پروتئین تاو بدشکل فقط به آن سمت میرود، یا تاو بدشکل از این طریق وارد سلول میشود؛ تاو عادی از راه دیگری. تحت این مدلها، دادههای بهظاهر متناقضی از لحاظ تاریخی تولید شده است؛ دادههایی که محققانی که آلزایمر را مطالعه میکنند، سخت تحت فشار قرار گرفتهاند.
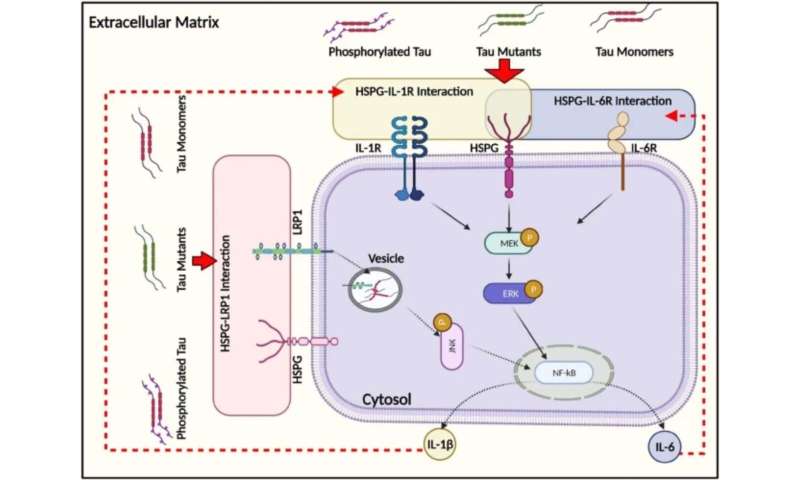
تصویر شماتیک از پاسخ های درون سلولی تحت تاثیر اندوسیتوز تاو مونومری. تاو مونومر به سرعت توسط سلول های عصبی و گلیال درونی می شود که با واسطه مسیر ماکروپینوسیتوز وابسته به اکتین انجام می شود. اعتبار: مهندسی شیمی کارنگی ملون
شواهد حاصل از مطالعه جدید رابسینسون این مدلهای همه یا هیچ را به چالش میکشد، زیرا تیم او اخیراً راههای دیگری را کشف کردهاند که سلولها میتوانند پروتئین تاو را جذب کنند، که در نهایت بر نحوه واکنش سلولها تأثیر میگذارد. به گفته رابینسون، در حالی که مدل های گذشته ممکن است ظاهراً با یافته های یکدیگر تناقض داشته باشند، اما به طور بالقوه همه آنها صحیح هستند و صرفاً به اندازه کافی کل نگر به جذب تاو نگاه نمی کردند. علاوه بر این، هیچ مدرکی مبنی بر اینکه سلولها راهی برای تمایز و مرتبسازی بین تاو طبیعی و بدشکل دارند، وجود ندارد.
رابینسون می گوید: «مردم اغلب فکر می کردند که یک پروتئین روی سطح سلول وجود دارد که مسئول جذب تاو است. اما چیزی که ما دریافتیم این است که در واقع چندین مسیر برای ورود تاو به سلولها وجود دارد. در حالی که تاو بیماریزا ممکن است کمی سریعتر از تاو معمولی جذب شود، نورونها و سایر سلولهای مغز هر دو شکل را نسبتاً سریع (در چند دقیقه) میگیرند. این بدان معناست که نگه داشتن نورون ها از تاو سالم، به جای تاو بدشکل، رویکرد درمانی بسیار ظریف تری را اتخاذ خواهد کرد.”
داده های جدید نشان می دهد که تلاش های گذشته برای ایجاد داروهای درمانی آلزایمر اشتباه بوده است. بر اساس مدلهای قبلی، اگر دانشمندان بتوانند مسیر، آنزیم یا پروتئینی را که مسئول جذب تاو بدشکل است بیابند، میتوانند با استفاده از یک روش درمانی، آن را خاموش کنند. در حالی که این رویکرد ممکن است به دلیل موفقیت استراتژی های مشابه برای بیماری هایی مانند فیبروز کیستیک و دیابت مناسب به نظر برسد، تحقیقات رابینسون ثابت می کند که این احتمالا هرگز به عنوان راهی برای درمان آلزایمر عمل نخواهد کرد.
“بر اساس یافتههای ما، آلزایمر نیاز به رویکرد مشابهی برای درمان HIV دارد، که در آن ترکیبی از داروهای مورد استفاده برای مقابله با عناصر مختلف این بیماری استفاده میشود. این داروها با هم به سمت هدف بزرگتر یعنی درمان علائم آلزایمر در یک بیمار خاص عمل میکنند. “
این دادههای جدید به دانشمندان درک بهتری از آلزایمر و نحوه گسترش آن میدهد و ما را یک قدم به سمت درمان بیماری که زندگی بسیاری را تحت تأثیر قرار میدهد نزدیکتر میکند.
مقاله تحقیقاتی با عنوان “پروتئوگلیکان های سولفات هپاران (HSPGs) به عنوان واسطه بین تاو مونومر و فعال سازی مسیر درون سلولی ERK1/2 آن عمل می کند” و در نشریه منتشر شده است. مجله علوم اعصاب مولکولی در 18 ژانویه 2022.
تحقیقات نشان می دهد که چگونه پاک کننده های مغز در ALS شکست می خورند
Liqing Song و همکاران، پروتئوگلیکان های سولفات هپاران (HSPGs) به عنوان واسطه بین تاو مونومر و فعال سازی مسیر ERK1/2 درون سلولی بعدی آن عمل می کنند. مجله علوم اعصاب مولکولی (2022). DOI: 10.1007/s12031-021-01943-2
ارائه شده توسط دانشگاه کارنگی ملون، گروه مهندسی شیمی
نقل قول: درمان آلزایمر بیش از حد انتظار طول می کشد. اینجاست که چرا (2022، 21 ژانویه) 21 ژانویه 2022 از https://medicalxpress.com/news/2022-01-alzheimer-longer.html بازیابی شده است
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
[ad_2]