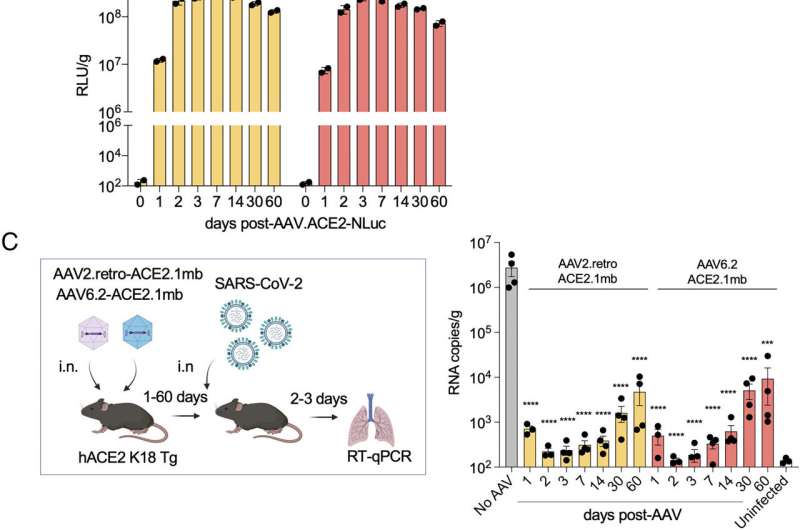
ایمونوپروفیلاکسی ناقلی بادوام با وکتورهای AAV بیان کننده طعمه. (آموش Balb/c (3 نفر) با وکتورهای AAV همجوشی پروتئین لوسیفراز (1 × 10) تزریق شدند.12 vg). فعالیت لوسیفراز با تصویربرداری زنده بیش از 60 روز در نقاط زمانی مشخص شده مشاهده شد. تصاویری از یک موش از هر گروه نشان داده شده است. (بفعالیت لوسیفراز در هموژنههای بافت ریه از موشهای تحت درمان با ناقلهای AAV بیانکننده لوسیفراز (n = 2) در طول دوره زمانی اندازهگیری شد. (سی) طرح آزمایشی برای آزمایش دوام ایمونوپروفیلاکسی ناقل AAV نمودار شده است (ترک کرد). hACE2 K18 Tg (n = 4) با طعمه AAV تزریق شد. در 1-، 2-، 3-dpi، موش ها با SARS-CoV-2 (2 × 10) به چالش کشیده شدند4 PFU) و RNA ویروسی در ریه ها اندازه گیری شد. نتایج به صورت هیستوگرام نشان داده شده است (درست). کنترلهای آلوده به SARS-CoV-2/AAV- درمان نشده (بدون AAV) و AAV درماننشده/غیر آلوده به SARS-CoV-2 (غیر آلوده) نشان داده شدهاند. CI به صورت میانگین ± SD نشان داده شده است. ****پ 0.0001 ≤. اعتبار: مجموعه مقالات آکادمی ملی علوم (2023). DOI: 10.1073/pnas.2303509120
یک مطالعه جدید نشان می دهد که یک “درو” آزمایشی محافظت طولانی مدت در برابر عفونت توسط ویروس همه گیر در موش ها ایجاد کرده است.
این کار به رهبری محققان دانشکده پزشکی گروسمن نیویورک، بر این اساس است که چگونه ویروس عامل COVID-19، SARS-CoV-2، از پروتئین اسپیک خود برای اتصال به پروتئینی در سطح سلولهایی که ریههای انسان را پوشاندهاند، استفاده میکند. هنگامی که به این پروتئین سطح سلولی، به نام آنزیم مبدل آنژیوتانسین 2 (ACE2) متصل می شود، سنبله ویروس سلول را نزدیک می کند و ویروس را قادر می سازد وارد سلول شده و ماشین آلات آن را برای ساخت نسخه های ویروسی ربوده است.
پیش از این در همهگیری، شرکتهای داروسازی آنتیبادیهای مونوکلونال را طراحی کردند تا بر روی سنبله نفوذ کرده و ویروس را خنثی کنند. درمان بیماران بلافاصله پس از عفونت در پیشگیری از بستری شدن در بیمارستان و مرگ موفقیت آمیز بود. با این حال، ویروس به سرعت از طریق تغییرات ژنتیکی تصادفی (جهش) تکامل یافت که شکل سنبله را به اندازه کافی تغییر داد تا حتی از ترکیب آنتی بادی های مونوکلونال درمانی نیز فرار کند. بنابراین، چنین آنتیبادیهایی که واریتههای اولیه را خنثی میکردند، حدود 300 برابر کمتر در برابر انواع جدید دلتا و اومیکرون مؤثر بودند.
منتشر شده آنلاین این هفته در مجموعه مقالات آکادمی ملی علوم، این مطالعه یک رویکرد جایگزین را توصیف می کند که ویروس نمی تواند از آن فرار کند. این نسخه از ACE2، پروتئین سطحی که ویروس به آن متصل میشود، استفاده میکند، که برخلاف نسخه طبیعی و متصل به سلول، از سطح سلول جدا شده است. “درو” شناور آزاد توسط میخ هایش به ویروس متصل می شود به طوری که دیگر نمی تواند به ACE2 روی سلول های مجاری هوایی بچسبد. برخلاف آنتیبادیهای مونوکلونال، که به گونهای شکل میگیرند که با شکل خاصی از سنبله تداخل داشته باشند، طعمه هدف اصلی سنبله را تقلید میکند و ویروس نمیتواند به راحتی از اتصال به ACE2 دور شود و همچنان به سلولها حمله کند.
درمان با طعمه، چه از طریق تزریق یا قطرات در بینی، 100 درصد از موشهای مورد مطالعه را هنگامی که در آزمایشگاه با دوز کشنده SARS-CoV-2 آلوده شدند، محافظت کرد. این طعمه بار ویروس را در موش ها 100000 برابر کاهش داد، در حالی که موش هایی که در معرض درمان غیرفعال کنترل بودند مردند. درمان با طعمه موش هایی که قبلاً به SARS-CoV-2 آلوده شده بودند باعث کاهش سریع سطح ویروس و بازگشت به سلامت شد. به گفته محققان، این نشان می دهد که این طعمه می تواند به عنوان یک درمان پس از عفونت، مشابه آنتی بادی های مونوکلونال، موثر باشد.
نویسنده ارشد این مطالعه میگوید: «آنچه در مطالعه ما قابل توجه است این است که ما طعمه را با استفاده از یک ویروس بیخطر و مرتبط با آدنو یا ناقل AAV، نوعی ژن درمانی که در مطالعات قبلی برای استفاده در انسان بیخطر است، تحویل دادیم». ناتانیال لاندو، دکترا، استاد دپارتمان میکروبیولوژی در NYU Langone Health. ناقل ویروسی به سلولهای بدن دستور میدهد تا طعمه را تولید کنند تا موش یا شخص در درازمدت بدون نیاز به درمان مداوم محافظت شود. لاندو میگوید که با استفاده از این ناقل، این درمان باعث شد که سلولها نه تنها طعمه را بسازند، بلکه به ساخت آن برای چندین ماه و به طور بالقوه برای سالها ادامه دهند.
نکته مهم این است که واکسنها بهطور سنتی شامل بخشهای بیضرر ویروسی هستند که قرار است در برابر آن محافظت کنند، که اگر فرد بعداً در معرض قرار گیرد، واکنش ایمنی محافظتی ایجاد میکند. با این حال، اگر سیستم ایمنی فرد به دلیل بیماری هایی مانند سرطان، یا در بیماران پیوندی که با داروهایی که پاسخ ایمنی به واکسیناسیون را سرکوب می کنند، تحت درمان قرار گرفته باشند، واکسن ها کمتر موثر هستند. لاندو می افزاید، رویکردهای فریبنده می تواند برای بیماران دچار نقص ایمنی در سطح جهان بسیار ارزشمند باشد.
همه گیری های آینده
برای مطالعه جدید، تیم تحقیقاتی تغییرات کلیدی را در یک مولکول گیرنده آزاد ACE2 ایجاد کردند و سپس قسمت اتصال سنبله آن را به انتهای دم یک آنتی بادی با هدف تقویت اثر ضد ویروسی آن ذوب کردند. چسباندن ACE2 به قطعه آنتی بادی برای تشکیل آنچه که تیم “میکروبادی ACE2” می نامند، زمان ماندگاری مولکول در بافت ها (نیمه عمر آن) را افزایش می دهد. این ترکیب همچنین باعث میشود که مولکولها دایمرهایی تشکیل دهند، جفتهای مولکولی شبیه آینه که قدرت اتصال طعمه به سنبله ویروسی را افزایش میدهند.
بردارهای AAV این مطالعه چه از طریق تزریق به عضله یا از طریق قطرات در حفره بینی انجام شود، موشها را از عفونت کووید محافظت طولانیمدت، از جمله انواع Omicron فعلی، در اختیار موشها قرار داد.
این رویکرد قول میدهد حتی اگر یک ویروس کرونای دیگر، نوعی ویروس رایج در پرندگان، خفاشها یا میمونها، در آینده به انسان منتقل شود، مؤثر خواهد بود، رویدادی که به آن «زوونوز» میگویند. تا زمانی که ویروس آینده از ACE2 برای هدف قرار دادن سلولها نیز استفاده کند، طعمه به زودی پس از شیوع بیماری آماده است. لاندو می گوید، اگر ویروس به نوعی گیرنده خود را با پروتئین متفاوتی روی سطح سلول های ریه تغییر دهد، این طعمه می تواند برای هدف قرار دادن ویروس جدید اصلاح شود.
همراه با لاندو، نویسندگان مطالعه تاکویا تادا و جولیا مینی در گروه میکروبیولوژی دانشکده پزشکی دانشگاه گروسمن نیویورک بودند.
اطلاعات بیشتر:
تاکویا تادا و همکاران، ایمونوپروفیلاکسی ناقل و درمان عفونت SARS-CoV-2 در یک مدل پیش بالینی، مجموعه مقالات آکادمی ملی علوم (2023). DOI: 10.1073/pnas.2303509120
ارائه شده توسط NYU Langone Health
نقل قول: «فریب» آزمایشی در برابر عفونت SARS-CoV-2 محافظت می کند (2023، 30 مه) در 30 مه 2023 از https://medicalxpress.com/news/2023-05-experimental-decoy-sars-cov-infection.html بازیابی شده است.
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
