اعتبار: موسسه جنیفر کوک-کریسوس/وایتهد
سرطان زمانی که گسترش مییابد و تومورهایی را در بافتهای جدید تشکیل میدهد، کشندهترین حالت خود را دارد. این فرآیند که متاستاز نامیده می شود، مسئول اکثر مرگ و میرهای ناشی از سرطان است، و با این حال هنوز چیزهای زیادی وجود دارد که محققان درباره چگونگی و زمان وقوع آن نمی دانند. رابرت واینبرگ، عضو مؤسس موسسه Whitehead، همچنین پروفسور Daniel K. Ludwig برای تحقیقات سرطان در موسسه فناوری ماساچوست، مکانیسم های پشت متاستاز را مطالعه می کند. یکی از این مکانیسمها فرآیندی به نام انتقال اپیتلیال-مزانشیمی (EMT) است که باعث میشود سلولهای اپیتلیال، که به طور معمول محکم به هم میچسبند، انسجام خود را از دست بدهند و آنها را قادر میسازد به اطراف حرکت کنند و حتی به بافت مجاور حمله کنند. این برنامه EMT همچنین در طول رشد جنینی عمل می کند. سلولهای سرطانی میتوانند این فرآیند را انتخاب کرده و از آن برای حرکت از محل تومور اصلی خود به بافتهای دوردست در سراسر بدن استفاده کنند. برخی از سلولهای سرطانی که گسترش مییابند، در موارد نادری قادر به ایجاد تومورهای جدید در این بافتها – متاستازها – هستند، در حالی که اکثریت بزرگ این سلولها پس از ورود به بافتهای دور، غیرفعال میمانند.
تحقیقات جدید از واینبرگ و پسادکتر یون ژانگ نشان میدهد که سلولها به روشهای مختلفی از طریق اعمال EMT تغییر میکنند، که میتواند بر اینکه سلولها قادر به تشکیل تومورهای جدید پس از گسترش هستند تأثیر بگذارد. اثر، منتشر شده در زیست شناسی سلولی طبیعت در 11 آوریل 2022، همچنین دو تنظیم کننده EMT را شناسایی می کند و نشان می دهد که از دست دادن هر تنظیم کننده منجر به پروفایل ریسک متاستاتیک متفاوتی می شود.
ژانگ میگوید: «با استفاده از سرطان سینه منفی سهگانه بهعنوان یک مدل، ما سعی میکنیم کمی عمیقتر به درک مکانیسمهای مولکولی تنظیمکننده EMT، نحوه ورود سلولها به حالتهای میانی EMT مختلف و اینکه کدام یک از این حالتها به متاستاز کمک میکنند، برویم.
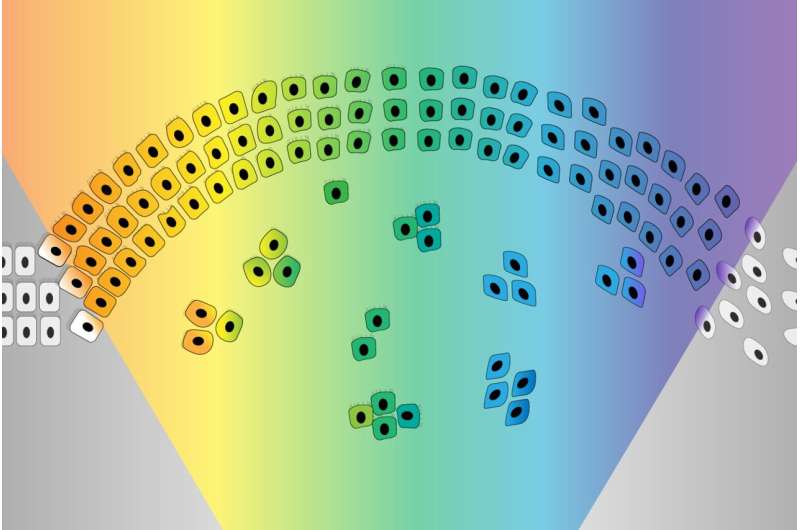
EMT در ابتدا به عنوان نوعی سوئیچ دوتایی تصور میشد که در آن سلولها از اپیتلیال شروع میشوند و به مزانشیمی تبدیل میشوند، دقیقاً مانند یک کلید نور که از حالت خاموش به روشن حرکت میکند. با این حال، محققان در حال یادگیری هستند که EMT بیشتر شبیه یک سوئیچ کم نور است که می تواند در طول طیفی از روشنایی جابجا شود. سلولهایی که تحت EMT قرار میگیرند، معمولاً به حالتهای هیبریدی بین انتهای اپیتلیال و مزانشیمی ختم میشوند. این سلولها در وسط طیف، که دارای برخی از ویژگیهای هر افراطی هستند، سلولهای “شبه مزانشیمی” نامیده میشوند و معلوم میشود که آنها – به جای سلولهایی که کاملاً مزانشیمی میشوند – بیشترین توانایی را برای متاستاز دادن و تشکیل سلولهای جدید دارند. تومورها در سراسر بدن
محافظت شده در برابر سلول های پلاستیکی
واینبرگ و ژانگ برای درک بهتر طیف EMT و آنچه که حرکت سلول ها را در طول آن کنترل می کند، تلاش کردند. اول، آنها سلول های اپیتلیال را با یکدیگر مقایسه کردند و دریافتند که برخی از آنها پلاستیکی تر یا مستعد انتقال در طول طیف EMT نسبت به سایرین هستند. آنها همچنین از ابزار ویرایش ژن CRISPR برای غربالگری ژن هایی که ممکن است انعطاف پذیری سلول ها را تنظیم کنند، استفاده کردند. اگر محققان بتوانند بفهمند چه چیزی باعث میشود یک سلول به حالت شبه مزانشیمی تبدیل شود – که خطر بالایی برای متاستاز دارد – ممکن است بتوانند از این اطلاعات در زمانی در آینده برای توسعه استراتژیهایی برای جلوگیری از ورود سلولها به این حالت پرخطر استفاده کنند.
صفحه نمایش ژن CRISPR تعدادی مولکول را نشان داد که به نظر می رسید بر انعطاف پذیری اپیتلیال- مزانشیمی سلول ها تأثیر می گذارد. دو گروه از این مولکولها اثرات بسیار قوی داشتند: PRC2، مجموعهای که در کروموزومها برای خاموش کردن یا غیرفعال کردن ژنها عمل میکند، و KMT2D-COMPASS، مجموعهای که به فعالسازی ژنها کمک میکند. هر دو کمپلکس به حفظ سلول ها در یک وضعیت اپیتلیال پایدار کمک می کنند. از دست دادن هر یک از این کمپلکس ها سلول ها را مستعد حرکت در امتداد طیف EMT می کند.
سپس محققان تعیین کردند که چگونه از دست دادن هر یک از این مجموعه ها EMT را فعال می کند. PRC2 به طور معمول چندین ژن کلیدی مرتبط با EMT را خاموش می کند. هنگامی که PRC2 از بین می رود، آن ژن ها فعال می شوند که به نوبه خود سلول را به سیگنالی حساس می کند که می تواند EMT را تحریک کند. از دست دادن KMT2D-COMPASS بر چگونگی اتصال PRC2 به اهداف خود تأثیر می گذارد که منجر به حساسیت سیگنال یکسان می شود. علیرغم مکانیسمهای مشابهی که در بازی وجود دارد، از دست دادن PRC2 در مقابل KMT2D-COMPASS سلولها را به سمت انتقال به حالتهای مختلف EMT سوق میدهد که یک یافته هیجانانگیز برای محققان است. سلولهای بدون KMT2D-COMPASS کاملاً مزانشیمی شدند، در حالی که سلولهای بدون PRC2 هیبریدی یا شبه مزانشیمی شدند. در نتیجه، سلولهای بدون PRC2 نسبت به سلولهای بدون KMT2D-COMPASS (یا سلولهایی که هر دو کمپلکس در آنها فعال بودند) در مدلهای موش، توانایی متاستاز بسیار بیشتری داشتند. هنگامی که محققان به داده های تاریخی بیماران مبتلا به سرطان سینه نگاه کردند، الگوی مشابهی را مشاهده کردند: افرادی که ژن های PRC2 معیوب داشتند، نتایج بدتری داشتند. این یافتهها شواهد بیشتری ارائه میدهند که سلولهای وسط طیف EMT به احتمال زیاد متاستاز میدهند.
این کار از درک EMT به عنوان یک طیف به جای یک سوئیچ ساده پشتیبانی می کند و نشان می دهد که تنظیم کننده های مختلف EMT می توانند سلول ها را برای انتقال به بخش های مختلف طیف EMT برنامه ریزی کنند. علاوه بر این، این یافته که از دست دادن PRC2 با متاستاز مرتبط است، پیامدهایی برای داروهای سرطانی در حال توسعه دارد که با غیرفعال کردن PRC2 کار می کنند. مزایای این داروها ممکن است برای بیماران مبتلا به انواع خاصی از سرطان که PRC2 یک هدف موثر برای آنهاست، بیشتر از خطرات آن باشد. با این حال، واینبرگ و ژانگ هشدار میدهند که محققانی که آزمایشهای بالینی داروهای هدفگیری PRC2 را انجام میدهند باید در انتخاب بیماران و نظارت بر نتایج مراقب باشند. در انواع سلولهای سرطانی که محققان بررسی کردند، حتی غیرفعالسازی موقت PRC2، مانند یک آزمایش درمانی، برای تحریک سلولها برای تبدیل شدن به هیبرید EMT با ظرفیت متاستاتیک افزایش یافته کافی بود.
واینبرگ و ژانگ قصد دارند به کاوش در ژنهای شناساییشده در صفحه CRISPR خود ادامه دهند تا ببینند آیا میتوانند سایر حالتهای هیبریدی را در امتداد طیف EMT شناسایی کنند، که در آن سلولها ترکیبات مختلفی از ویژگیهای اپیتلیال و مزانشیمی دارند. آنها امیدوارند که با تعمیق درک خود از پروفایل های بیان ژن سلول های سرطانی مرتبط با مسیرهای مختلف EMT، بتوانند به توسعه درمان برای افراد مبتلا به سرطان های متاستاتیک بالقوه کمک کنند.
واینبرگ میگوید: «درک اینکه چه زمانی و چگونه سلولهای سرطانی قادر به تشکیل متاستازهای تهدیدکننده زندگی میشوند، برای کمک به بسیاری از بیمارانی که این امر برایشان یک خطر است، ضروری است. “این کار بینش جدیدی در مورد مکانیسم هایی ارائه می دهد که سلول ها را قادر می سازد متاستاز بدهند و نقش هایی که برنامه های EMT مختلف می توانند ایفا کنند.”
روشی برای فعالسازی مجدد ژنهای مبارزه با تومور که توسط سرطان خاموش شدهاند کشف شد
یون ژانگ و همکاران، صفحه نمایش CRISPR در سطح ژنوم، PRC2 و KMT2D-COMPASS را به عنوان تنظیم کننده مسیرهای متمایز EMT شناسایی می کند که به طور متفاوتی در متاستاز نقش دارند. زیست شناسی سلولی طبیعت (2022). DOI: 10.1038/s41556-022-00877-0
ارائه شده توسط موسسه تحقیقات زیست پزشکی Whitehead
نقل قول: بینشهای جدید در مورد مکانیسمهایی که سلولهای سرطانی را قادر به متاستاز میکنند (2022، 12 آوریل) در 12 آوریل 2022 از https://medicalxpress.com/news/2022-04-insights-mechanisms-enable-cancer-cells.html بازیابی شده است.
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
