تومورهای اولیه از راه دور باعث ایجاد اختلال در عملکرد متابولیک در کبد می شوند. اعتبار: طبیعت (2023). DOI: 10.1038/s41586-023-06114-4
بر اساس مطالعه محققان Weill Cornell Medicine، سرطانها اغلب مولکولهایی را در جریان خون آزاد میکنند که به طور پاتولوژیک کبد را تغییر میدهند، آن را به حالت التهابی تغییر میدهند، باعث تجمع چربی و اختلال در عملکرد طبیعی سمزدایی آن میشوند.
این کشف یکی از مکانیسمهای موذیانهتر بقای سرطان را روشن میکند و امکان آزمایشها و داروهای جدید برای شناسایی و معکوس کردن این فرآیند را پیشنهاد میکند.
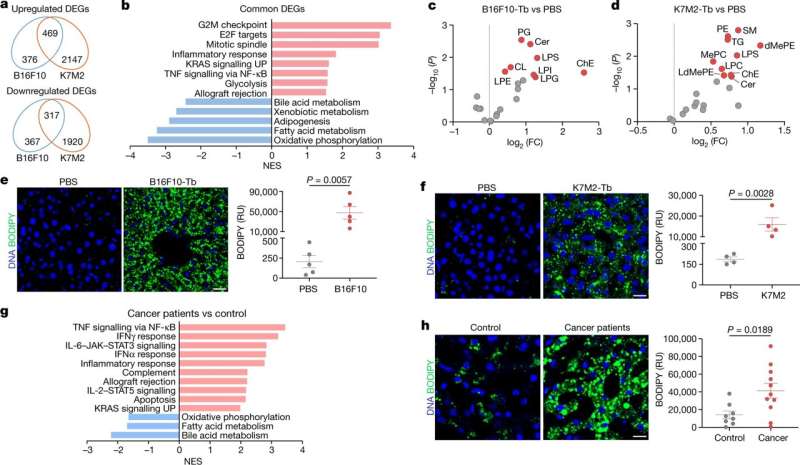
در مطالعه منتشر شده در طبیعتمحققان دریافتند که طیف گستردهای از انواع تومور که در خارج از کبد رشد میکنند، از راه دور کبد را از طریق ترشح وزیکولها و ذرات خارج سلولی حاوی اسیدهای چرب به حالتی شبیه به بیماری کبد چرب برنامهریزی میکنند. دانشمندان شواهدی از این فرآیند را در مدل های حیوانی سرطان و در کبد بیماران سرطانی انسانی یافتند.
دکتر دیوید لیدن، نویسنده ارشد این مطالعه، پروفسور Stavros S. Niarchos در قلب و عروق کودکان، گفت: یافته های ما نشان می دهد که تومورها می توانند منجر به عوارض سیستمیک قابل توجهی از جمله بیماری کبد شوند، اما همچنین نشان می دهد که این عوارض را می توان با درمان های آینده برطرف کرد. و استاد اطفال و زیست شناسی سلولی و تکاملی در پزشکی ویل کورنل.
در دو دهه گذشته، لیدن، که همچنین عضو موسسه گیل و ایرا دروکیر برای سلامت کودکان و مرکز سرطان ساندرا و ادوارد مایر در پزشکی ویل کورنل است، و گروه تحقیقاتی او در حال بررسی اثرات سیستمیک سرطان ها بوده اند. این اثرات منعکس کننده استراتژی های خاصی است که سرطان ها برای تضمین بقای خود و سرعت بخشیدن به پیشرفت خود استفاده می کنند.
برای مثال، در کار خود که در سال 2015 منتشر شد، این تیم کشف کردند که سرطانهای پانکراس مولکولهای محصور شده در وزیکولهای خارج سلولی را ترشح میکنند که در جریان خون حرکت میکنند، توسط کبد جذب میشوند و اندام را برای حمایت از رشد تومورهای متاستاتیک جدید آماده میکنند.
در مطالعه جدید، محققان مجموعه متفاوتی از تغییرات کبدی ناشی از سلولهای سرطانی دوردست را کشف کردند که در مدلهای حیوانی سرطان استخوان، پوست و سینه مشاهده کردند که به سایر اندامها متاستاز میدهند اما به کبد متاستاز نمیدهند. یافته کلیدی این مطالعه این است که این تومورها باعث تجمع مولکولهای چربی در سلولهای کبدی میشوند و در نتیجه کبد را بهگونهای برنامهریزی مجدد میکنند که شبیه شرایط مرتبط با چاقی و الکل است که به عنوان بیماری کبد چرب شناخته میشود.
این تیم همچنین مشاهده کردند که کبدهای برنامه ریزی شده مجدد دارای سطوح بالایی از التهاب هستند که با افزایش سطح فاکتور نکروز تومور-α (TNF-α) و سطوح پایین آنزیم های متابولیزه کننده دارو به نام سیتوکروم P450 مشخص می شود که مولکول های بالقوه سمی، از جمله بسیاری را تجزیه می کند. مولکول های دارو کاهش مشاهده شده در سطح سیتوکروم P450 می تواند توضیح دهد که چرا بیماران سرطانی اغلب با پیشرفت بیماری خود تحمل کمتری نسبت به شیمی درمانی و سایر داروها دارند.
محققان این برنامهریزی مجدد کبد را به EVPهایی که توسط تومورهای دور آزاد میشوند و حامل اسیدهای چرب، بهویژه اسید پالمیتیک هستند، ردیابی کردند. وقتی محموله اسید چرب توسط سلول های ایمنی ساکن کبد به نام سلول های کوپفر جذب می شود، باعث تولید TNF-α می شود که در نتیجه تشکیل کبد چرب را تحریک می کند.
اگرچه محققان عمدتاً از مدل های حیوانی سرطان ها در این مطالعه استفاده کردند، اما تغییرات مشابهی را در کبد بیماران سرطان لوزالمعده تازه تشخیص داده شده مشاهده کردند که بعداً متاستازهای غیر کبدی ایجاد کردند.
یکی از مشاهدات قابل توجه ما این بود که این بیماری کبد چرب ناشی از EVP همزمان با متاستازهای کبدی رخ نمی دهد، که نشان می دهد ایجاد کبد چرب و آماده سازی کبد برای متاستاز، استراتژی های مشخصی هستند که سرطان ها برای دستکاری عملکرد کبد استفاده می کنند. – نویسنده اول گانگ وانگ، دانشیار فوق دکترا در آزمایشگاه لیدن. جیان لونگ لی، یک همکار علمی در آزمایشگاه لیدن، نیز اولین نویسنده این مطالعه است.
دانشمندان گمان می کنند که بیماری کبد چرب تا حدی با تبدیل کبد به منبع انرژی مبتنی بر لیپید برای تقویت رشد سرطان به سرطان ها کمک می کند.
دکتر رابرت شوارتز، نویسنده ارشد این مطالعه گفت: ما در سلولهای کبد نه تنها تجمع غیرطبیعی چربی را میبینیم، بلکه از پردازش طبیعی لیپیدها دور میشویم، به طوری که لیپیدهایی که تولید میشوند برای سرطان مفیدتر هستند. ، دانشیار پزشکی در بخش گوارش و کبد در پزشکی ویل کورنل و متخصص کبد در مرکز پزشکی نیویورک-پرسبیتریان/ویل کورنل.
این ممکن است تنها مزیت سرطان ها از این تغییر کبد نباشد.
هایینگ ژانگ، استادیار زیست شناسی سلولی و تکوینی، می گوید: مولکول های مهمی نیز در عملکرد سلول های ایمنی دخیل هستند، اما تولید آنها در این کبدهای چرب تغییر می کند، که نشان می دهد این وضعیت ممکن است ایمنی ضد تومور را نیز تضعیف کند. در اطفال در پزشکی ویل کورنل.
محققان توانستند این اثرات سیستمیک تومورها بر روی کبد را با اجرای استراتژیهایی مانند مسدود کردن انتشار تومور-EVP، مهار بستهبندی اسید پالمیتیک در EVPهای تومور، سرکوب فعالیت TNF-α یا حذف سلولهای کوپفر در مدلهای حیوانی آزمایشی کاهش دهند. .
محققان در حال بررسی بیشتر پتانسیل اجرای این استراتژی ها در بیماران انسانی برای جلوگیری از این اثرات دور تومورها بر روی کبد هستند و امکان استفاده از تشخیص پالمتیک اسید در EVP های تومور در گردش خون را به عنوان یک علامت هشدار دهنده بالقوه از پیشرفت های پیشرفته بررسی می کنند. سرطان.
اطلاعات بیشتر:
گنگ وانگ و همکاران، وزیکول ها و ذرات خارج سلولی تومور باعث ایجاد اختلال در عملکرد متابولیک کبد می شوند. طبیعت (2023). DOI: 10.1038/s41586-023-06114-4
ارائه شده توسط دانشگاه کرنل
نقل قول: سرطان در اندامهای دور عملکرد کبد را تغییر میدهد، نشان میدهد مطالعه (2023، 25 مه) در 25 مه 2023 از https://medicalxpress.com/news/2023-05-cancers-distant-liver-function.html بازیابی شده است.
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
