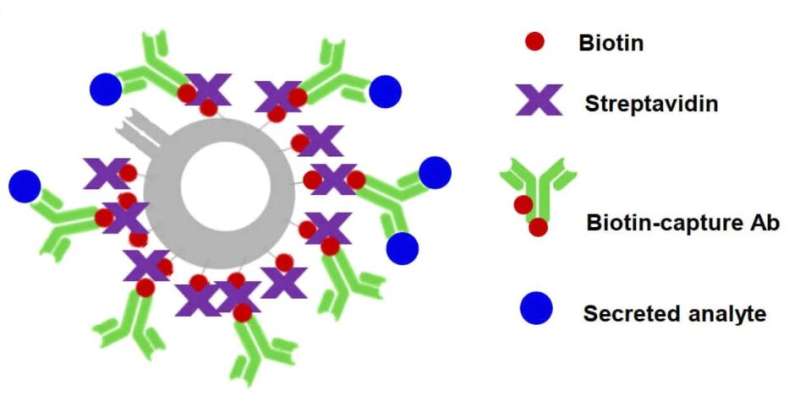
نمودار شماتیک اصل بیوتینیلاسیون سطح سلولی با سولفو-NHS-بیوتین را به عنوان یک روش جهانی برای ایجاد مکان های لنگر برای گرفتن آنتی بادی بر روی سطوح سلول در زمانی که نشانگر سطح خاصی در دسترس نیست نشان می دهد. سطوح سلولی بیوتینیله را می توان با استرپتاویدین اصلاح کرد تا هر نوع آنتی بادی های جذب کونژوگه با بیوتین را بی حرکت کند. اعتبار: روش های طبیعت (2023). DOI: 10.1038/s41592-023-01841-y
سلول ها با ترشح پروتئین هایی که به عنوان پیام رسان یا سیگنال برای برقراری ارتباط با سلول های دیگر عمل می کنند، با محیط اطراف خود تعامل دارند. گرفتن این پروتئینهای گریزان و ریز ترشح شده، بهویژه آنهایی که از سلولهای ایمنی بدن ما تولید میشوند، و ارتباط آنها با سلولهای منشأ فردی میتواند بینشهای مهمی در مورد پاسخهای ایمنی در بیماران مبتلا به بیماریهای مزمن مانند سرطان، اختلالات خودایمنی یا بیماریهای عفونی ارائه دهد و این روند را تسریع کند. توسعه ایمنی درمانی
با این حال، مطالعه چگونگی ارتباط، تعامل و هماهنگی سلولهای ناسالم یا سالم با یکدیگر در پاسخ به محرکها یا عوامل بیماریزا، چالشی برای دانشمندان باقی مانده است.
تیمی از محققان دانشگاه ملی سنگاپور (NUS) به سرپرستی دستیار پروفسور Cheow Lih Feng از دپارتمان مهندسی بیومدیکال تحت کالج طراحی و مهندسی NUS، برای کمک به پر کردن شکاف در ارتباط عملکرد سلولی با پروتئینهای ترشح شده آنها، همچنین موسسه NUS برای نوآوری و فناوری سلامت، تکنیک جدیدی به نام ارزیابی زمان حلشده ترشح پروتئین تکسلولی با توالییابی (TRAPS-seq) برای تسهیل مطالعه پاسخ سلولهای ایمنی در سطح تک سلولی ابداع کرده است.
«داشتن عکسهای فوری پیشرونده از مکانیسم پویای سلولهای ایمنی – از پاسخ به عفونت ویروسی گرفته تا از بین بردن تهدید – میتواند توسعه استراتژیهای درمانی جدید را برای درمان بیماری تسریع کند، مانند مکانیسمهایی که برای سلولهای سرطانی انتخابی هستند و در نتیجه سلولهای سالم را حفظ میکنند. و عوارض جانبی را کاهش دهید. پروفسور چئو علاوه بر این، درک بهتر نحوه ارتباط سلولهای سالم میتواند بینشهای ارزشمندی در مورد فرآیندهای سلولی طبیعی مختل شده در سرطان ارائه دهد.
این پیشرفت فناوری در گزارش شد روش های طبیعت در 10 آوریل 2023.
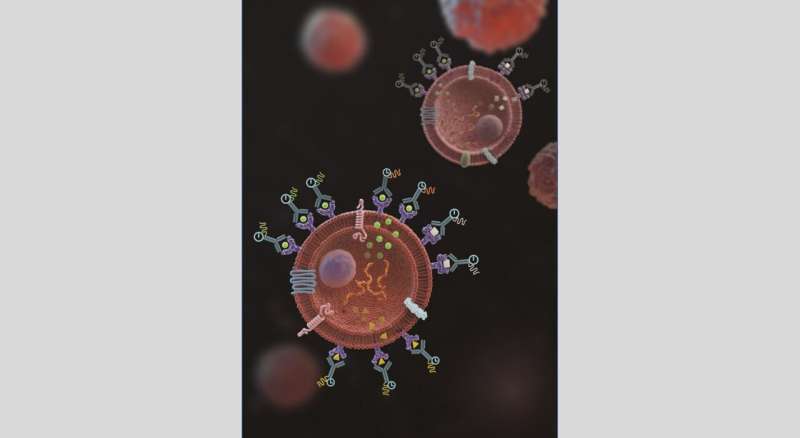
جذب پروتئین های ترشح شده بر روی سطوح سلولی منبع آنها با استفاده از ماتریس میل ترکیبی، اندازه گیری همزمان ترشح پروتئین، پروتئین های سطح سلولی و رونویسی را در هزاران سلول با وضوح تک سلولی امکان پذیر می کند. اعتبار: دانشگاه ملی سنگاپور
ابزاری قدرتمند برای جمع آوری داده ها در مورد عملکرد سلول
TRAPS-seq از پروتئینهای سطحی روی سلول برای لنگر انداختن پروتئینهای ترشح شده توسط سلول استفاده میکند که سپس میتوان آنها را به راحتی با تکنیکهای موجود در حال حاضر تجزیه و تحلیل کرد. مزیت منحصر به فرد این روش نسبت به سایر تکنیک های موجود، توانایی آن در ردیابی سلول منبع ترشح کننده پروتئین ها و اندازه گیری تغییرات ترشح در طول زمان زمانی که به یک محرک پاسخ می دهد است.
با اصلاح پروتئینهای سطح سلول، میتوانیم از آنها به عنوان قلابی برای لنگر انداختن پروتئین ترشح شده به محض بیرون آمدن از سطح سلول استفاده کنیم. دکتر Wu Tongjin، نویسنده ارشد مقاله توضیح داد تا عملکرد سلول را مستقیما با رونویسی و مشخصات فنوتیپی سطح آن مرتبط کند.
برای آزمایش دوام این روش، تیم NUS از TRAPS-seq برای نظارت همزمان سه نوع پروتئین سیتوکین ترشح شده از سلولهای T، یک نوع گلبول سفید که به سیستم دفاعی بدن ما برای مبارزه با بیماریهای مختلف مرتبط است، استفاده کرد. محرک این تیم توانست تغییرات دینامیکی این پروتئینهای ترشح شده را در طول زمان ردیابی کند و زیرجمعیتهایی از سلولهای T را مشاهده کند که الگوهای دینامیکی متفاوت و پروفایلهای ترشح پروتئین را نشان میدهند، که نشاندهنده پتانسیل استفاده از این روش برای کشف مکانیسمهای سلولی پویا جدید است.
Cheow گفت: “TRAPS-seq این فرصت را فراهم می کند تا مشخصات ترشح پروتئین تک تک سلول ها را اندازه گیری کنیم و تفاوت های عملکردی آنها را برطرف کنیم. در شرایط غیر طبیعی، تغییرات در ترشح پروتئین پیامدهای گسترده ای برای سیستم ایمنی بدن، توسعه بافت ها و پیشرفت بیماری خواهد داشت. این تکنیک جدید دارای پتانسیل بالایی به عنوان ابزاری قدرتمند برای دانشمندان است تا اهداف درمانی بیماریهای مربوط به ترشح پروتئین نامنظم را کشف کنند.
مراحل بعدی
در حال حاضر، تیم NUS میتواند سه پروتئین ترشحشده را در یک زمان مشخص کند، اما محققان در تلاش هستند تا تعداد پروتئینهای ترشحشده را بهطور همزمان به ۱۰ افزایش دهند.
سنجش TRAPS-seq برای هر پروتئین ترشح شده کار می کند، اگرچه کاربردهای فوری در پروفایل ایمونولوژی احتمالاً وجود دارد. محققان خوشبین هستند که کاتالوگ های گسترده جفت آنتی بادی تایید شده برای ایمونواسی مرتبط با آنزیم (ELISA) می تواند با TRAPS-seq سازگار شود تا طیف وسیعی از پروتئین های ترشح شده را برای کاربردهای مختلف شناسایی کند.
اطلاعات بیشتر:
Tongjin Wu و همکاران، ارزیابی زمان حل شده ترشح پروتئین تک سلولی با تعیین توالی، روش های طبیعت (2023). DOI: 10.1038/s41592-023-01841-y
ارائه شده توسط دانشگاه ملی سنگاپور
نقل قول: محققان ابزار قدرتمندی برای جمعآوری دادههای مربوط به پاسخ ایمنی در سطح تک سلولی اختراع کردند (2023، 6 ژوئن) که در 7 ژوئن 2023 از https://medicalxpress.com/news/2023-06-powerful-tool-immune-response-single بازیابی شده است. -cell.html
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
