
تحقیقات دکتر لئوناردو فریرا شامل بهینه سازی گیرنده های آنتی ژن کایمریک روی سلول های T برای هدایت بهتر سلول های T به سمت اهداف خاص است. اعتبار: Marquel Coaxum
دکتر لئوناردو فریرا، محقق مرکز سرطان هولینگز دانشگاه پزشکی کارولینای جنوبی (MUSC) که به دلیل کار پیشگامانه اش با سلول های T تنظیمی مورد توجه قرار گرفته است، مقاله ای را در مرزها در ایمونولوژی که تجربه او را با استفاده از سلول های T تنظیم کننده گیرنده آنتی ژن کایمریک (CAR) برای مقابله با چالش تحمل پیوند توصیف می کند.
فریرا، که در اول جولای به بخش ایمونولوژی دانشگاه پزشکی کارولینای جنوبی پیوست، با بهرهبرداری از زیستشناسی منحصربهفرد سلولهای T تنظیمکننده یا Tregs، قوانین بازی را تغییر میدهد. هدف کلی تحقیق او درک کامل زیست شناسی Treg به منظور استفاده از سلول ها برای درمان طیف وسیعی از مشکلات خود ایمنی است.
زمانی که دکترای خود را در هاروارد میگرفتم، به سیستم ایمنی علاقهمند شدم. استاد راهنمای من دکتر جک استرومینگر بود، که ساختار پروتئینهای HLA را در دهه 1980 متبلور کرد. درک HLA در ایمونولوژی بسیار مهم است، زیرا یکی از آنهاست. فریرا توضیح داد که «کلیدهای» اصلی چگونگی تشخیص سلولهای بدن ما از سلولهای خارجی یا خود در مقابل غیر خود.
فریرا در دوره پسا دکتری خود در دانشگاه کالیفرنیا سانفرانسیسکو (UCSF)، تمرکز خود را بر مهندسی سیستم ایمنی گیرندگان پیوند اعضا برای کاهش رد پیوند معطوف کرد. “در حال حاضر، یافتن یک همتا برای بیمارانی که نیاز به پیوند عضو دارند دشوار است. این به این دلیل است که مطابقت با پروتئین های HLA یک مانع بزرگ است. انسان ها دارای 18 نوع مختلف پروتئین HLA هستند، به همین دلیل است که یک پایگاه داده عظیم اهداکنندگان عضو وجود دارد. با این حال تعداد کمی از بیماران با اهداکنندگان مطابقت دارند.”
فریرا سیستم ایمنی را یک ارتش می داند. Tregs “ژنرال” هستند و سلول های ایمنی دیگر “سربازان” هستند. Tregs سایر سلولهای ایمنی را با سرکوب آنها در زمانی که بیش از حد فعال میشوند، مانند خودایمنی، هدایت میکنند و با اجازه دادن به آنها در صورت وجود تهدید، مانند عفونت یا سرطان، به طور کامل عمل میکنند.
فریرا گفت: “سیستم ایمنی در همه عملکردهای بدن نقش دارد، ایستا نیست. سلول های T دارای دید “اشعه ایکس” با کورکننده هستند تا فقط پروتئین های درون سلولی سلول های دیگر را ببینند که قرار است به آنها حمله کنند.”
در پنج سال گذشته، او خودروهای CAR را برای هدایت سلولهای T به سمت اهداف خاص بهینهسازی کرده است. یک CAR جایگزین گیرنده سطح طبیعی سلول T، گیرنده سلول T یا TCR می شود، که سلول T را به یک مجتمع پروتئینی HLA سطحی اختصاص می دهد. تحقیقات Ferreira شامل گرفتن سلول های ایمنی از افراد و مطالعه آنها با هدف استفاده از Tregs به عنوان “داروهای زنده” است.
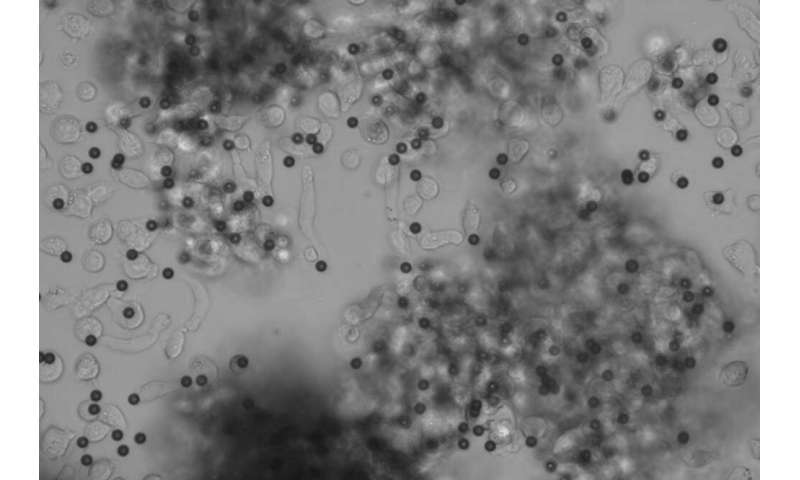
به دنبال تحریک توسط مهره های پوشیده شده با آنتی بادی ها (کره های تیره)، سلول های T تنظیم کننده، خوشه های “پنبه مانند” را در اطراف مهره ها تشکیل می دهند. شکلهای دراز «موز مانند» سلولهای T تنظیمکنندهای هستند که خوشهها را ترک کردهاند تا عملکرد خود را انجام دهند. اعتبار: MUSC
دیابت نوع 1 یک مدل مفید برای تعیین اینکه آیا CAR Tregs از نظر درمانی عمل می کند یا خیر است. CAR Tregs برای رفتن به پانکراس و خاموش کردن آتش خودایمنی طراحی شده است. او گفت که از امسال 100 سال است که از انسولین به عنوان یک درمان دیابت نوع 1 استفاده می شود، اما منشا این مشکل را درمان نمی کند. ایمونولوژی می تواند با متوقف کردن التهاب مزمنی که باعث بیماری می شود، ریشه مشکل را پیدا کند.
فریرا گفت که تحقیق شرح داده شده در مرزها در ایمونولوژی مقاله یکی از اولین مقالاتی است که CAR Tregs را با استفاده از روش ویرایش ژنی به نام CRISPR-Cas9 مهندسی دقیق کرد. این فرآیند مانند استفاده از چاقوی جراحی برای برداشتن دقیق Treg TCR و سپس قرار دادن CAR در جای خود است. این روش ایمن تر است زیرا تضمین می کند که فقط یک نسخه از CAR وجود دارد و CAR به همان روشی که TCR اصلی تنظیم می شود.
فریرا و همکارانش در UCSF با استفاده از یک مدل موش “انسانی” دیابت با سلول های جزایر انسانی و سلول های ایمنی انسان دریافتند که CAR Tregs می تواند التهاب مضر را به تاخیر بیاندازد یا کاهش دهد. او گفت که زیست شناسی غنی Tregs به تازگی در حال بررسی است و استفاده از CAR ها ممکن است تحمل مصنوعی با ویژگی را فراهم کند. فریرا اکنون در آزمایشگاه خود در هالینگز مطالعاتی را برای بهینه سازی و درک کامل زیست شناسی CAR Treg انجام می دهد.
چالشهای ترجمهای وجود دارد که باید قبل از اینکه CAR Tregs به داروهای زنده تبدیل شود، غلبه کرد، مانند هزینه و تایید. یکی از موانع بیولوژیکی این است که Tregs تنها حدود 1 تا 2 درصد از گلبول های سفید را تشکیل می دهد، بنابراین دریافت سلول های کافی برای درمان یک چالش است.
فریرا معتقد است که مهم است که ترکیبی از پروژه های تحقیقاتی علوم پایه و ترجمه در حال انجام باشد، زیرا نتایج هر دو حوزه تحقیقاتی را نشان می دهد.
“من در مورد استفاده از امکانات سلول تمیز اینجا در MUSC هیجان زده هستم. من یک گاراژ پر از ماشین های مختلف دارم و مشتاقم تا نحوه کار آنها را مطالعه کنم. این پتانسیل وجود دارد که برخی از CAR Tregs می توانند در سرطان استفاده شوند، و Hollings نیز چنین است. فریرا گفت که مکان مناسبی برای همکاری با محققان سرطان است.
چشم انداز او برای برنامه ایمونولوژی در هولینگز این است که به مرکز سرطان کمک کند تا درمان های سلولی خود را گسترش دهد و بخشی از قابل دسترس تر کردن این درمان برای بیماران باشد. او گفت: “یک پویایی تعاملی قدرتمند بین دانشکده تحقیقات در اینجا وجود دارد. اندازه کوچکتر هیئت علمی همراه با فضای مشارکتی، منابع ترجمه و تسهیلات سلول پاک cGMP، این زمان هیجان انگیزی را برای عضویت در این جامعه تحقیقاتی بزرگ در MUSC ایجاد می کند.” .
افزایش اشتهای سیستم ایمنی برای محافظت از سرطان
Yannick D. Muller و همکاران، مهندسی دقیق گیرنده آنتی ژن کایمریک Anti-HLA-A2 در سلول های T تنظیمی برای تحمل ایمنی پیوند، مرزها در ایمونولوژی (2021). DOI: 10.3389/fimmu.2021.686439
ارائه شده توسط دانشگاه پزشکی کارولینای جنوبی
نقل قول: محقق ایمنی شناسی زیست شناسی سلول های T تنظیمی را برای توسعه داروهای زنده بررسی می کند (2021، 15 نوامبر) در 15 نوامبر 2021 از https://medicalxpress.com/news/2021-11-immunology-probes-regulatory-t-cell-biology بازیابی شده است. html
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
