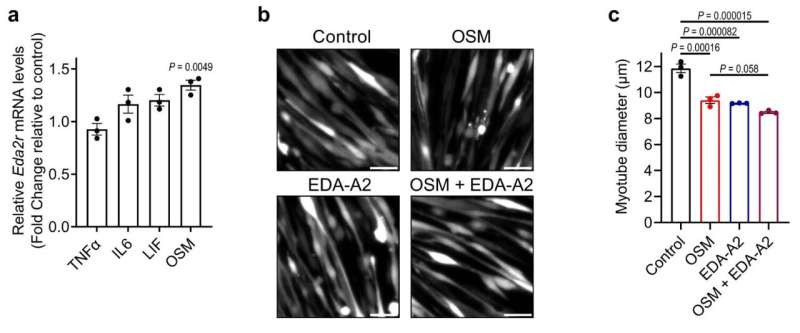
OSM بیان Eda2r را در عضله القا می کند و کاهش OSMR از تحلیل رفتن عضلات محافظت می کند. a، میوتوب های اولیه موش با TNFα نوترکیب، IL-6، LIF و OSM (هر کدام 250ng/ml) تیمار شدند. سطوح mRNA توسط RT-qPCR (n = 3) تعیین شد. میوتوب های اولیه b,c، موش با OSM نوترکیب و EDA-A2 (هر کدام 250ng/ml) به مدت 48 ساعت تحت درمان قرار گرفتند. میوتوب های تحت درمان با آدنوویروس GFP نیز در زیر میکروسکوپ فلورسانس مشاهده شدند. نوار مقیاس 50 میکرومتر (b) است. اعتبار: طبیعت (2023). DOI: 10.1038/s41586-023-06047-y
محققان دپارتمان بیولوژی مولکولی و ژنتیک در دانشگاه Koc ترکیه و قطب غدد درون ریز، دیابت و تغذیه، موسسه تحقیقات تجربی و بالینی در دانشگاه کاتولیک دو لوون در بلژیک، برای بررسی مکانیسمهای هدر رفتن مرتبط با سرطان همکاری کردهاند. سندرم – کاشکسی
مقاله “سیگنال دهی EDA2R-NIK باعث آتروفی عضلانی مرتبط با کاشکسی سرطان می شود” منتشر شده در طبیعت، جزئیات کشف چگونگی پیوند جایگزین اکتودیسپلاسین A (EDA) به یک مسیر سیگنالینگ در آسیب شناسی کاشکسی را نشان می دهد. یک قطعه News & Views که در همان مجله منتشر شده است، یافته های این مطالعه را تشریح می کند.
EDA، یک نوع سیتوکین، متعلق به فاکتور نکروز تومور (TNF) از خانواده پروتئین های سیگنال دهی است که توسط گلبول های سفید برای انجام کار سیستم ایمنی بدن ساخته می شود. محققان کشف کردند که پیوند جایگزین EDA، EDA2R پیام رسان RNA، در بافت های عضلانی اسکلتی موش های مبتلا به سندرم هدر رفتن کاشکسی غنی شده است.
سندرم هدر رفتن
کاشکسی اغلب در سرطان های پیشرفته پانکراس و ریه و اغلب با سرطان های روده بزرگ، تخمدان و کبد ظاهر می شود.
کاشکسی که به عنوان کاهش 5 درصد یا بیشتر از وزن بدن طی شش ماه گذشته تعریف می شود، همچنین می تواند باعث خستگی و کاهش قدرت شود. این تعریف به تنهایی معیاری خام از یک وضعیت فیزیولوژیکی پیچیدهتر است که میتوان آن را در تشخیص نادیده گرفت زیرا اثرات مشابهی با درمانهای سرطان دارد.
آتروفی فیزیکی همراه با کاشکسی میتواند تسریع شود، زیرا ممکن است بیمار قادر به انجام کارهای معمولی مانند حمام کردن، خرید کردن یا تغذیه خود نباشد، چه به دلیل کمبود انرژی بدنی یا عدم اشتها. مسائل مربوط به سلامت روان می تواند به سرعت دنبال شود. علاوه بر این، عواقب کاشکسی به طور مستقیم عامل تقریباً یک سوم مرگهای ناشی از سرطان در هنگام نارسایی قلبی یا تنفسی به دلیل از دست دادن عضله در نظر گرفته میشود.
بدون یک مکانیسم شناخته شده، حتی یک تشخیص می تواند بدون درمان موثر و یک دوره عمل روشن، کاربرد محدودی در محیط های بالینی داشته باشد.
همبستگی جذاب
از طریق جستجوی بیان ژن در بیوپسی عضلانی، محققان افزایش mRNA EDA2R را در بیماران مبتلا به سرطانهای کاشکتیک (سرطانهای ریه، دستگاه گوارش، پانکراس و کولورکتال) در مقایسه با بیماران سرطانی بدون کاشکسی و کنترلهای بدون سرطان تشخیص دادند.
علاوه بر این، تیم دریافت که بیمارانی که از کاهش توده عضلانی و عملکرد مبتلا به دیستروفی عضلانی دوشن (DMD) و دیستروفی عضلانی فاسیوسکاپولوهومرال (FSHD) رنج میبرند، رونوشت EDA2R نیز به میزان قابل توجهی افزایش یافته است.
با شناسایی همبستگی مسیر EDA-A2-EDA2R، محققان این تحقیقات را بیشتر دنبال کردند.
کشف مکانیسم ها
این تیم با شروع کشت بافت و پیشرفت به مدل موش، بارها دریافتند که افزایش سطح پروتئین EDA-A2 اثرات مضری دارد. آنها کاهش اندازه سلول را در کشت های بافت مشاهده کردند و آزمایشات in vivo موش ها انحطاط عمیق عضلانی را نشان دادند.
آزمایشها همچنین اثرات پاییندستی EDA-A2 را پس از تعامل با گیرنده آن نشان دادند. کیناز القاکننده NFĸB (NIK)، یک تنظیم کننده کلیدی فاکتورهای رونویسی که بیان تعداد قابل توجهی از ژن ها را کنترل می کند، برای فعال کردن ژن هایی که آنزیم هایی را که می توانند بافت های عضلانی را تجزیه می کنند رونویسی کنند، به حرکت در می آید.
در بالادست بیان گیرنده EDA2R، محققان انکوستاتین M (OSM) ناشی از تومور را به عنوان یک تنظیم کننده کلیدی شناسایی کردند. کاهش RNA پیام رسان OSM در عضلات از آنها در برابر تحلیل رفتن و آتروفی محافظت می کند.
نتایج مطالعه نشان می دهد که سیگنال دهی OSM-OSMR به موازات مسیر EDA2R-NIK عمل می کند و آتروفی عضلانی و تنظیم دخیل EDA2R را تقویت می کند.
حذف EDA2R یا NIK در موش ها برای ایجاد مقاومت در برابر تحلیل عضلانی ناشی از تومور کافی بود. نویسندگان پیشنهاد می کنند که هدف قرار دادن مسیر OSM-OSMR نیز می تواند یک هدف درمانی با ارزش باشد.
مانند پایان هر مطالعه خوب، تحقیقات بیشتری مورد نیاز است. گامهای بعدی ممکن است تعیین این باشد که کدام اهداف دارای بهترین نسبتهای ریسک به فایده هستند و درک روابط علّی را به سمت یک مداخله بالینی پیش ببرند.
اطلاعات بیشتر:
Sevval Nur Bilgic و همکاران، سیگنالینگ EDA2R-NIK باعث آتروفی عضلانی مرتبط با کاشکسی سرطان می شود. طبیعت (2023). DOI: 10.1038/s41586-023-06047-y
لورا آنتونیو هررا و همکاران، مبنای مولکولی برای از دست دادن عضله که باعث کاشکسی می شود، طبیعت (2023). DOI: 10.1038/d41586-023-01527-7
© 2023 Science X Network
نقل قول: مکانیسم گریزان از کاشکسی با سندرم هدر رفت نشان داده شد (2023، 16 مه) در 17 مه 2023 از https://medicalxpress.com/news/2023-05-elusive-mechanism-syndrome-cachexia-revealed.html بازیابی شده است.
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
