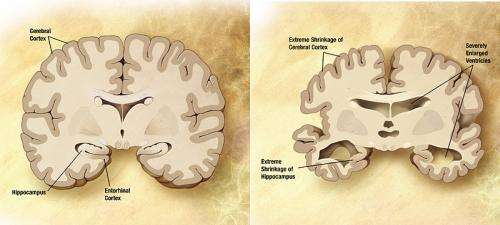
نمودار مغز افراد مبتلا به آلزایمر. اعتبار: ویکی پدیا/دامنه عمومی.
مطالعهای که در مرکز سلامت مغز Emory انجام شد نشان میدهد که افزایش سطوح انتقالدهنده عصبی نوراپی نفرین با آتوموکستین، یک داروی ADHD، ممکن است بتواند تخریب عصبی را در افراد مبتلا به علائم اولیه بیماری آلزایمر متوقف کند.
نتایج در 17 دسامبر در مجله منتشر شد مغز.
این یکی از اولین مطالعات بالینی منتشر شده است که تأثیر قابل توجهی را بر پروتئین Tau نشان می دهد که در آلزایمر رگه های عصبی فیبریلاری را در مغز ایجاد می کند. در 39 فرد مبتلا به اختلال شناختی خفیف (MCI)، شش ماه درمان با اتوموکستین باعث کاهش سطح تاو در مایع مغزی نخاعی (CSF) شرکت کنندگان در مطالعه شد و سایر نشانگرهای التهاب عصبی را عادی کرد.
این مطالعه به یک استراتژی دارویی جایگزین در برابر آلزایمر اشاره میکند که بر آنتیبادیهای ضد تاو یا دیگر پروتئین مرتبط با آلزایمر، بتا آمیلوئید، متکی نیست. داروی اخیر مورد تایید FDA، آداکانوماب، بتا آمیلوئید را هدف قرار می دهد، اما مزایای آن در میان متخصصان در این زمینه بحث برانگیز است.
محققان Emory نتیجه گرفتند که مطالعات بزرگتر و طولانی تر روی اتوموکستین در MCI و آلزایمر ضروری است. این دارو تأثیر قابل توجهی بر شناخت یا سایر پیامدهای بالینی نداشت که با توجه به مدت زمان نسبتاً کوتاه مطالعه انتظار می رفت.
نویسنده ارشد، دکتر دیوید واینشنکر، استاد ژنتیک انسانی در دانشکده پزشکی دانشگاه اموری، میگوید: «یکی از مزایای اصلی آتوموکستین این است که قبلاً توسط FDA تأیید شده و به عنوان ایمن شناخته شده است». “اثرات مفید اتوموکستین بر فعالیت شبکه مغز و نشانگرهای التهاب CSF، خوش بینی را تضمین می کند.”
آلن لوی، نویسنده اصلی، MD، Ph.D.، استاد نورولوژی در دانشکده پزشکی دانشگاه اموری و مدیر موسسه Goizueta @Emory Brain Health میگوید: «ما از نتایج کارآزمایی دلگرم هستیم. این درمان بیخطر بود، در افراد مبتلا به اختلال شناختی خفیف به خوبی قابل تحمل بود، و نوراپینفرین انتقالدهنده عصبی مغز را همانطور که فرض کردیم تعدیل کرد. علاوه بر این، مطالعات اکتشافی ما نتایج امیدوارکنندهای را در مورد تصویربرداری و بیومارکرهای زیستی مایع نخاعی نشان میدهد که باید در مطالعات بزرگتر دنبال شوند. دوره درمان طولانی تر.”
محققان Emory اتوموکستین را که به عنوان Strattera به صورت تجاری در دسترس است، با هدف افزایش سطح نوراپی نفرین در مغز انتخاب کردند که به نظر آنها می تواند ناحیه آسیب پذیر مغز را در برابر تخریب عصبی مرتبط با آلزایمر تثبیت کند.
نوراپی نفرین عمدتاً توسط لوکوس سرولئوس تولید می شود، ناحیه ای از ساقه مغز که به نظر می رسد اولین ناحیه ای است که آسیب شناسی مرتبط با آلزایمر را نشان می دهد – حتی در افراد سالم و میانسال. تصور می شود نوراپی نفرین التهاب را کاهش می دهد و سلول های حذف کننده زباله به نام میکروگلیا را تشویق می کند تا تجمعات پروتئین هایی مانند بتا آمیلوئید و تاو را پاک کنند. افزایش سطح نوراپی نفرین اثرات مثبتی بر شناخت و آسیب شناسی در مدل های موش و موش آلزایمر دارد.
واینشنکر می گوید: «چیزی که ممکن است بدیهی به نظر برسد، اما کاملاً ضروری بود، یافته ما این بود که آتوموکستین به شدت سطح نوراپی نفرین CSF را در این بیماران افزایش می دهد. برای بسیاری از داروها و آزمایشها، اثبات تعامل هدف بسیار دشوار است. ما توانستیم به طور مستقیم تعامل هدف را ارزیابی کنیم.»
واینشنکر همچنین تاکید کرد که این کارآزمایی ناشی از تحقیقات پیش بالینی انجام شده در مدل های حیوانی است که پتانسیل نوراپی نفرین را نشان می دهد.
کل ایده استفاده از اتوموکستین برای درمان اختلالات شناختی خفیف و بیماری آلزایمر ناشی از تحقیقاتی بود که با استفاده از جوندگان برای مدلسازی و دستکاری جنبههای این اختلالات انجام میشد و بدون کمک مالی مؤسسه ملی بهداشت، انجمن آلزایمر، آلزایمر امکانپذیر نبود. بنیاد کشف دارو و اهداکنندگان خصوصی.” “حمایت از تحقیقات حیوانی برای پیشرفت های زیست پزشکی در زمینه تخریب عصبی بسیار مهم است.”
مطالعه Emory بین سالهای 2012 و 2018 با طرحی متقاطع انجام شد، به طوری که نیمی از گروه در شش ماه اول آتوموکستین دریافت کردند و نیمی دیگر دارونما دریافت کردند – سپس افراد تغییر کردند. ممکن است شرکتکنندگانی که در شش ماه اول آتوموکستین دریافت کردهاند، پس از قطع درمان، اثرات انتقالی را تجربه کردهاند، بنابراین دوره شش ماهه دوم آنها لزوماً یک دارونمای خالص نبوده است.
بر اساس اندازهگیری تاو و بتا آمیلوئید، همه شرکتکنندگان در مطالعه با اختلال شناختی خفیف تشخیص داده شدند و نشانگرهای پیشرفت احتمالی آلزایمر در CSF خود داشتند.
محققان سطوح ده ها پروتئین را در CSF شرکت کنندگان اندازه گیری کردند. کاهش تاو از درمان با آتوموکستین اندک بود – حدود پنج درصد در طول شش ماه – اما در صورت تداوم، می تواند تأثیر بیشتری بر آسیب شناسی آلزایمر داشته باشد. اثر معنی داری بر روی بتا آمیلوئید مشاهده نشد.
علاوه بر این، در شرکتکنندگانی که اتوموکستین مصرف میکردند، محققان توانستند افزایش متابولیسم را در لوب گیجگاهی داخلی، که برای حافظه حیاتی است، از طریق تصویربرداری مغزی PET (توموگرافی گسیل پوزیترون) تشخیص دهند.
شرکت کنندگان در مطالعه با دوز کم اتوموکستین شروع کردند و دوز بالاتر را تا 100 میلی گرم در روز افزایش دادند. شرکت کنندگان کاهش وزن (به طور متوسط 4 پوند) و افزایش ضربان قلب (حدود 5 ضربه در دقیقه) را در حین مصرف آتوموکستین تجربه کردند، اما افزایش قابل توجهی در فشار خون نشان ندادند. برخی از افراد عوارض جانبی مانند علائم گوارشی، خشکی دهان یا سرگیجه را گزارش کردند.
FDA در سال 2002 آتوموکستین را برای ADHD (اختلال بیش فعالی کمبود توجه) در کودکان و بزرگسالان تایید کرد و نشان داده شده است که این دارو در بزرگسالان مسن تر بی خطر است. در مقایسه با محرکهای معمولی که معمولاً برای ADHD تجویز میشوند، پتانسیل سوء مصرف کمی دارد.
واینشنکر میگوید با نگاهی به آینده، اکنون میتوان یکپارچگی لوکوس سرولئوس را در افراد زنده با استفاده از تکنیکهای MRI تجسم کرد، بنابراین این میتواند بخش مهمی از یک مطالعه بعدی بزرگتر باشد. اثرات اتوموکستین اخیراً در افراد مبتلا به بیماری پارکینسون مورد مطالعه قرار گرفته است – به نظر می رسد این فواید در افرادی که یکپارچگی لوکوس سرولئوس را کاهش داده اند بیشتر باشد.
تجمع اولیه تاو در مغز کاهش حافظه در بیماری آلزایمر را پیش بینی می کند
Allan I. Levey و همکاران، مطالعه فاز دوم در مورد استفاده مجدد از اتوموکستین برای محافظت عصبی در اختلالات شناختی خفیف، مغز (2021). DOI: 10.1093/brain/awab452
مغز
ارائه شده توسط دانشگاه اموری
نقل قول: استراتژی جایگزین برای متوقف کردن تخریب عصبی آلزایمر (2021، 22 دسامبر) در 22 دسامبر 2021 از https://medicalxpress.com/news/2021-12-alternative-strategy-stalling-alzheimer-neurodegeneration.html بازیابی شده است.
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به غیر از هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوای مذکور فقط به هدف اطلاع رسانی ایجاد شده است.
